
分析 (1)元素符号的左上角数字为质量数,左下角数字为质子数,两者之差为中子数,质子数相同,中子数不同的原子互称为同位素;
(2)根据根据SO42-、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用氢氧化钠除去镁离子,最后用碳酸钠去除过量的钡离子;
(3)利用氯气和氢氧化钠溶液反应来处理尾气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,次氯酸钠为“84”消毒液的主要成分;
(4)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,漂白粉的有效成分是次氯酸钙,长期露置于空气中的漂白粉,变质生成碳酸钙,加稀盐酸后产生的气体为二氧化碳;
(5)电解饱和食盐水生成氢氧化钠、氢气和氯气;具有强氧化性的物质能使湿润的淀粉KI试纸变蓝色;氢气在氯气中燃烧火焰呈苍白色.
解答 解:(1)${\;}_{92}^{235}$U是的原子核内的中子数为235-92=143,质子数为92,则中子数与质子数之差143-92=51,${\;}_{92}^{235}$U中子数为143,${\;}_{92}^{238}$U中子数为:238-92=146,两者为互称同位素,
故答案为:51;同位素;
(2)SO42-、Mg2+、Ca2+等分别与BaCl2溶液、NaOH溶液、Na2CO3溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加NaOH、Na2CO3溶液,最后加入盐酸,
故答案为:NaOH;Na2CO3;
(3)为了防止氯气尾气污染空气,可用NaOH溶液吸收,该反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,次氯酸钠为“84”消毒液的主要成分,其中+1价的氯具有氧化性而能漂白,易使带色衣物脱色,
故答案为:NaOH;Cl2+2NaOH=NaCl+NaClO+H2O;NaClO;
(4)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为:Cl2+Ca(OH)2=CaCl2+Ca(ClO)2+H2O,漂白粉的有效成分是次氯酸钙,长期露置于空气中的漂白粉,会和空气中的二氧化碳水反应生成碳酸钙和次氯酸,次氯酸分解,最后组要是碳酸钙,加稀盐酸后产生的气体是二氧化碳;故选C;
故答案为:Cl2+Ca(OH)2=CaCl2+Ca(ClO)2+H2O;Ca(ClO)2;C;
(5)电解饱和食盐水阴极生成氢气,阳极上生成氯气,阳极电极反应式为2Cl--2e-═Cl2,阴极上的电极反应式为2H++2e-=H2↑,总的化学方程式为2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,Cl2具有强氧化性,能使湿润的淀粉KI试纸中的碘离子被氧化成单质碘,碘单质遇淀粉变蓝色,氢气在氯气中燃烧火焰呈苍白色,
故答案为:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;湿润的碘化钾淀粉;苍白.
点评 本题考查了粗盐的提纯、氯气化学性质的应用、氯气的处理方法、电解池原理等知识,侧重氯及其化合物的性质的考查,明确氯气、漂白粉的性质是解答本题的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中存在:c(OH-)=c(H+)+c(H2CO3) | |
| B. | 某二元弱酸强碱盐NaHA溶液中存在:c(Na+)+c(H+)=c(A2-)+c(HA-)+c(OH-) | |
| C. | CH3COONa和NaCl混合溶液中存在:c(Na+)=c(CH3COO-)+c(Cl-) | |
| D. | 常温下,10mL 0.02mol•L-1 HCl溶液与10mL 0.01mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | 1.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +5 | B. | +4 | C. | +3 | D. | +2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将少量SO2气体通入NaClO溶液中:2ClO-+SO2+H2O→SO32-+2HClO | |
| B. | 硫化氢气体通入硫酸亚铁溶液产生黑色硫化亚铁沉淀:H2S+Fe2+→FeS↓+2H+ | |
| C. | 向偏铝酸钠溶液中通入过量CO2:AlO2-+CO2+2H2O→Al(OH)3↓+HCO3- | |
| D. | 向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
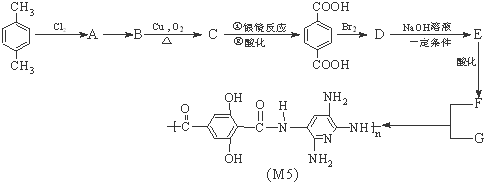
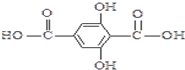 .
.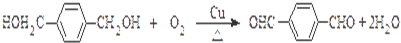 ,
,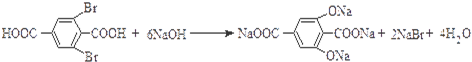 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84% | B. | 8.4% | C. | 1.6% | D. | 16% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com