
【题目】Ⅰ.已知C、H2、CO的燃烧热的数据如表所示:
物质 | C | H2 | CO |
ΔH/kJ·mol-1 | -393.5 | -285.8 | -283.0 |
(1)写出C完全燃烧的热化学方程式:_____。
(2)能表示H2燃烧热的热化学方程式为____。
(3)现以H2或CO为燃料来提供热能,从热能的角度考虑,你认为最好选择__(填写序号)。
A.H2 B.CO C.均可以
理由是___。
Ⅱ.已知下列热化学方程式:
①H2O(l)=H2(g)+![]() O2(g) ΔH=+285.8 kJ/mol
O2(g) ΔH=+285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
回答下列问题:
(4)上述反应中属于吸热反应的是___(填序号)。
(5)燃烧10gH2生成液态水,放出的热量为___。
【答案】C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ/mol A 等质量的H2完全燃烧放出的热量比CO多,且H2的燃烧产物为H2O,对环境无污染 ① 1429 kJ
O2(g)=H2O(l) ΔH=-285.8kJ/mol A 等质量的H2完全燃烧放出的热量比CO多,且H2的燃烧产物为H2O,对环境无污染 ① 1429 kJ
【解析】
⑴C完全燃烧的热化学方程式为C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol,
⑵H2燃烧热的热化学方程式为H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ/mol,
O2(g)=H2O(l) ΔH=-285.8kJ/mol,
⑶H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ/mol,
O2(g)=H2O(l) ΔH=-285.8kJ/mol,
CO(g)+![]() O2(g)=CO2(g) ΔH=--283.0 kJ/mol,等质量的H2完全燃烧放出的热量比CO多,且H2的燃烧产物为H2O,对环境无污染,因此从热能的角度考虑,H2为燃料来提供热能是最好选择,故答案为A;等质量的H2完全燃烧放出的热量比CO多,且H2的燃烧产物为H2O,对环境无污染
O2(g)=CO2(g) ΔH=--283.0 kJ/mol,等质量的H2完全燃烧放出的热量比CO多,且H2的燃烧产物为H2O,对环境无污染,因此从热能的角度考虑,H2为燃料来提供热能是最好选择,故答案为A;等质量的H2完全燃烧放出的热量比CO多,且H2的燃烧产物为H2O,对环境无污染
⑷①H2O(l)=H2(g)+![]() O2(g) ΔH=+285.8 kJ/mol是吸热反应,
O2(g) ΔH=+285.8 kJ/mol是吸热反应,
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol是放热反应,
O2(g)=H2O(g) ΔH=-241.8 kJ/mol是放热反应,
③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol是放热反应,
故答案为①;
氢气燃烧热的热化学方程式为H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ/mol,
O2(g)=H2O(l) ΔH=-285.8kJ/mol,
10g氢气物质的量为![]() ,放出的热量Q=285.8kJ/mol×5mol = 1429 kJ,故答案为1429 kJ。
,放出的热量Q=285.8kJ/mol×5mol = 1429 kJ,故答案为1429 kJ。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。现通过下列生产过程,从该样品中回收铁红。流程如下:
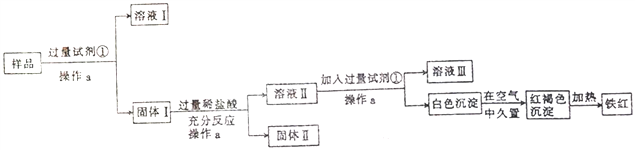
(1)操作a是________,在实验室进行该操作需要的玻璃仪器有烧杯、漏斗和_______。
(2)试剂①是_______,固体II是_________(填化学式)。
(3)红褐色沉淀的成分是_________;写出白色沉淀转化为红褐色沉淀的化学方程式:______________。
(4)溶液II中铁元素的存在形式是_______(填离子符号),如何用实验证明:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.01molL-1KAl(SO4)2溶液中的SO42-数目为0.02NA
B.用浓盐酸分别与MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为NA
D.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
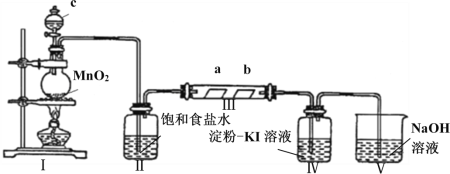
(1)装置Ⅰ中仪器c的名称是_______________,实验室以二氧化锰和浓盐酸制备氯气的离子方程式为_______________________________________________________。
(2)装置Ⅱ的作用是________________________。
(3)实验过程中装置Ⅳ中的实验现象为______________________________。
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与III之间添加下图中的_______装置(填序号)。

(5)装置Ⅴ的目的是防止尾气污染空气,写出装置Ⅴ中发生反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨反应的能量变化如图所示,该反应的热化学方程式是

A. N2(g)+3H2(g)=2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g) ΔH=2(b-a)kJ·mol-1
C. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1
H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1
D. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1
H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经测定乙醇的分子式为C2H6O。由于有机物普遍存在同分异构现象,推测乙醇结构可能是下列两种之一:(I)CH3CH2OH(II)CH3OCH3。为测定其结构,应利用物质的特殊性进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,请甲、乙、丙三位同学直接利用如图给定的装置进行实验,确定乙醇的结构。
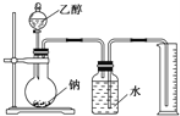
(1)学生甲得到一组实验数据:
乙醇的物质的量(mol) | 氢气的体积(标况)(L) |
0.10 | 1.13 |
0.10 | 1.11 |
0.10 | 1.12 |
0.10 | 1.18 |
请根据上表,帮助甲同学正确处理实验数据,氢气体积的平均值为__(L),由此推断乙醇的结构应为__式(用I或II表示),理由是___。写出乙醇与钠反应的化学方程式:___。
(2)同学乙分别准确称量4.60g乙醇进行多次实验,结果发现以排到量筒内的水的体积,作为生成的H2体积总是小于1.12L(换算成标准状况后)。如果忽略量筒本身及读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗?___(填“正确”或“不正确”)。如果不正确,请说明理由:____。
(3)同学丙认为实验成功的关键有:①装置气密性要良好②实验开始前准确确定乙醇的量③钠足量④广口瓶内必须有足量水⑤氢气体积的测算方法正确、数值准确⑥应了解实验时的温度和大气压强。其中正确的有____。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量的Cu和Fe2O3组成的混合物,平均分成两等分,向其中一份加入2mol/L的盐酸溶液150mL,恰好完全溶解,所得溶液加入KSCN无血红色出现。若用过量的CO在高温下还原原混合物,固体质量减少为
A.1.6gB.2.4gC.3.2gD.4.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示,下列说法正确的是

A.负极区发生的反应有Fe3++e-= Fe2+,4Fe2++O2+4H+=4Fe3++2H2O
B.Fe2+在过程中起催化剂作用
C.阳极材料可选用Ag
D.电路中转移1 mol电子时,消耗氧气5.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1)一种镍催化法生产GaN的工艺如图:
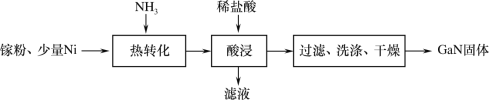
①镓(Ga)的原子结构示意图为![]() ,镓元素在周期表中的位置是___。
,镓元素在周期表中的位置是___。
②“热转化”时Ga转化为GaN的化学方程式是___。
③“酸浸”操作目的是___。
(2)某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
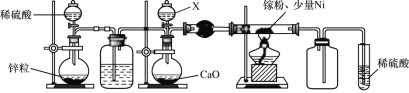
①仪器X中的试剂是__,加热前需先通入一段时间的H2,原因是__。
②取某GaN样品m克溶于足量热NaOH溶液,发生反应GaN+OH﹣+H2O![]() GaO2-+NH3↑,用H3BO3溶液将产生
GaO2-+NH3↑,用H3BO3溶液将产生![]() NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com