
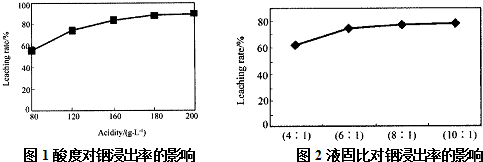

分析 (1)①根据酸度的定义计算,酸度为196时,说明1L溶液中硫酸的质量为196g,即硫酸为2mol,故浓度为2mol/L;
②根据图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大;
(2)①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,可用于生产硫酸;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,可根据氢氧化铝的反应来书写.
解答 解:(1)①酸度为196时,说明1L溶液中硫酸的质量为196g,硫酸的物质的量为$\frac{196g}{98g/mol}$=2mol,浓度为2mol/L,
故答案为:2mol•L-1;
②由图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大,从节约原料和浸出率考虑,适宜的酸度和液固比分别为:180; 6:1,
故答案为:180; 6:1;
(2)①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,如随意排放会污染环境,可用于生产硫酸,故答案为:将烟道气净化,用于生产硫酸等;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③根据Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,酸浸出液还含有Cd2+,为了防止镉污染并回收镉,可加过量的碱溶液,反应分别为:Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-].
故答案为:Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-].
点评 本题以信息题目的形式考查金属冶炼的一般原理,做题时注意题中给予的关键信息,如闪锌矿的组成,酸度等问题,本题较为综合,具有一定难度.


科目:高中化学 来源: 题型:选择题
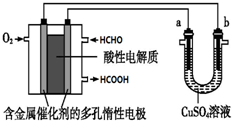
| A. | 当a、b都是铜做电极时,电解的总反应方程式为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑ | |
| B. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4 OH- | |
| C. | 当燃料电池消耗2.24L 甲醛气体时,电路中理论上转移2mol e- | |
| D. | 燃料电池工作时,负极反应为:HCHO+H2O-2e-═HCOOH+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15 | B. | 16 | C. | 17 | D. | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -317.3kJ/mol | B. | +317.3 kJ/mol | C. | -379.3kJ/mol | D. | -332.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
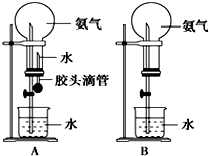 制取氨气并完成喷泉实验(图中夹持装置均已略去).
制取氨气并完成喷泉实验(图中夹持装置均已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素 | |
| B. | 利用油脂在碱性条件下的水解,可以生产甘油和肥皂 | |
| C. | 植物油通过氢化可以制造植物奶油(人造奶油) | |
| D. | 脂肪是有机体组织里储存能量的重要物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
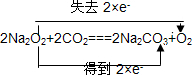 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 甲烧杯a电极反应式为:4OH--4e-═O2↑+2H2O | |
| C. | 电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 当b极增重3.2g时,d极产生的气体为2.24L(标准状况下) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com