
【题目】(1)已知常温时,0.1mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=_____,醋酸的电离平衡常数Ka=______。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:
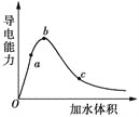
①a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是___。
②a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)_______c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | HCN |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=5.0×10-10 |
请回答下列问题:
①H2CO3的第二级电离平衡常数的表达式Ka2=_______。
②25℃时,向0.1molL-1的氨水中缓缓通入CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是___。
A.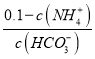 B.
B.![]() C.
C.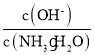 D.
D.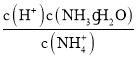
③向NaCN溶液中通入少量CO2气体,发生反应的离子方程式为___。
【答案】4 10-7 c>b>a > 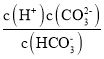 AC CN--+CO2+H2O=HCN-+HCO3-
AC CN--+CO2+H2O=HCN-+HCO3-
【解析】
(1)依据弱电解质的电离度分析计算pH,计算平衡浓度结合电离平衡常数概念计算平衡常数;
(2)①溶液体积越大,醋酸电离程度越大;
②25℃时,铵盐溶液pH=7,则溶液中存在c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(NH4+),所以两点溶液中c(CH3COO-)越大则该点溶液中的c(NH4+)越大;
(3)①根据弱酸的电离平衡常数的含义书写H2CO3的第二级电离平衡常数的表达式Ka2;
弱酸的电离平衡常数越大,其酸性越强,其酸根的水解程度越弱;
②25℃时,向0.1 molL-1的氨水中缓缓少量CO2气体,二者反应生成碳酸铵,溶液中存在电荷守恒和物料守恒;
③次氯酸酸性大于碳酸氢根离子,反应生成碳酸氢钠和次氯酸。
(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,依据电离度=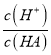
可知,c(H+)=0.1mol/L×0.1%=1×10-4mol/L,则溶液的pH=-lg(H+)=4;依据弱电解质的电离平衡HA![]() H++A-,Ka=
H++A-,Ka=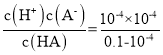 ≈1×10-7;
≈1×10-7;
(2)①溶液体积越大,醋酸电离程度越大,根据图知,溶液体积:a<b<c,则醋酸电离程度:c>b>a;
②25℃时,铵盐溶液pH=7,则溶液中存在c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(NH4+),所以两点溶液中c(CH3COO-)越大则该点溶液中的c(NH4+)越大,由于溶液中c(CH3COO-):a>c,则c(NH4+):a>c;
(3)①H2CO3是二元弱酸,其第二步电离平衡为HCO3-![]() H++CO32-,由于电离平衡常数为电解质达到电离平衡时,电解质电离产生的离子浓度的乘积与未电离的电解质浓度的比,所以其平衡常数表达式为Ka2=
H++CO32-,由于电离平衡常数为电解质达到电离平衡时,电解质电离产生的离子浓度的乘积与未电离的电解质浓度的比,所以其平衡常数表达式为Ka2=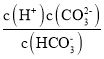 。
。
②随着二氧化碳的通入生成的碳酸铵逐渐增多,溶液中c(NH4+)增大,则c(NH3H2O)=0.1-c c(NH4+)减小、溶液中c(HCO3-)增大,则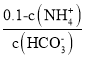 减小,A正确;
减小,A正确;
B.随着二氧化碳的通入生成的碳酸铵逐渐增多,溶液碱性减弱,则c(H+)增大、c(OH-)减小,则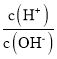 增大,B错误;
增大,B错误;
C.温度不变电离平衡常数不变,随着二氧化碳的通入,溶液中c(NH4+)增大,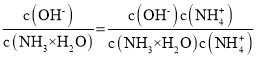 =
=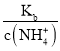 减小,C正确;
减小,C正确;
D.温度不变离子积常数及电离平衡常数不变,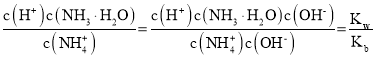 不变,D错误;
不变,D错误;
故合理选项是AC;
③根据电离平衡常数可知酸性:HClO>HCO3-,向次氯酸钠溶液中通入少量二氧化碳,反应生成碳酸氢根离子,该反应的离子方程式为:CN--+CO2+H2O=HCN-+HCO3-。


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,气体密度不变
④恒温恒压时,充入惰性气体,平衡不移动
⑤加入催化剂,B的平衡转化率提高
A.①②B.②C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
CuS(s)+Mn2+(aq)下列有关叙述中正确的是( )
①MnS的Ksp大于CuS的Ksp ②达到平衡时c(Mn2+)=c(Cu2+) ③溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)保持不变 ④该反应平衡常数K=
A. ①④ B. ②③
C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为不同温度下水的电离平衡曲线,已知pOH=lgc(OH),下列说法正确的是
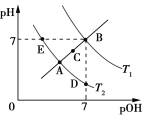
A. T1和T2的关系是:T1>T2
B. KW的关系是:B>C>A=D=E
C. A点到D点:加入少量酸可实现
D. T2时:pH=2的硫酸与pH=12的NaOH溶液等体积混合,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
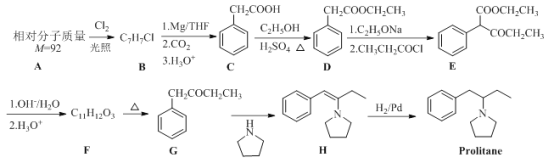
【题目】Prolitane是一种抗抑郁药物,以芳香烃A为原料的合成路线如下:
请回答以下问题:
(1)D的化学名称为______,H→Prolitane的反应类型为______。
(2)E的官能团名称分别为______和______。
(3)B的结构简式为______。
(4)F→G的化学方程式为______。
(5)C的同分异构体中能同时满足下列条件的共有______种(不含立体异构);
①属于芳香化合物 ②能发生银镜反应 ③能发生水解反应
其中核磁共振氢谱显示为4组峰,其峰面积比为3∶2∶2∶1,写出符合要求的该同分异构体的结构简式______。
(6)参照Prolitane的合成路线,设计一条由苯和乙醇为原料制备苯甲酸乙酯的合成路线_____________(其他无机试剂和溶剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.苯与溴水、酸性高锰酸钾溶液不反应,说明苯分子中碳原子间只存在单键
B.煤是由有机物和无机物所组成的复杂的混合物
C.相同质量的烷烃完全燃烧时,甲烷的耗氧量最高
D.乙烯可在催化剂作用下与H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是
![]()
A. 灼烧过程中使用的玻璃仪器有酒精灯、烧杯、玻璃棒
B. 氧化过程中发生反应的离子方程式为 2I-+H2O2 =I2+2OH-
C. 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明海带中含有碘单质
D. 分液时,先打开活塞放出下层液体,再关闭活塞从上口倒出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子数比s电子数少1个,Z的一种超原子![]() 具有40个价电子,下列说法错误的是( )
具有40个价电子,下列说法错误的是( )
A.![]() 的空间构型为平面三角形
的空间构型为平面三角形
B.简单离子半径:![]()
C.![]() 中心原子的杂化方式为
中心原子的杂化方式为![]() 杂化
杂化
D.化合物ZY的结构与X的某种单质的结构相似
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com