
| 共价键 | C--C | C=C | C--H | H一H |
| 键能(KJ•mol-1) | 348 | 610 | 413 | 436 |
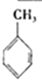 (g)+3H2(g)→
(g)+3H2(g)→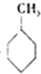 (g)△H=-384KJ•mol-1
(g)△H=-384KJ•mol-1| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
分析 ①、从不同状态的物质之间的转化判断,一般来说,气体转化为液体、液体转化为固体,反之吸热;
②、MgCO3溶液中,Mg2+离子和CO32-离子都能水解,水解后离子浓度不相等,存在碳酸镁固体的溶液是饱和溶液,所以在相同的温度下,溶度积常数相同;
③、苯环中不存在典型的碳碳双键和碳碳单键,不能用表中数据进行计算;
④、NH3•H2O溶液中加入少量NH4Cl晶体,平衡向逆方向移动,电离程度降低
解答 解:①、气体转化为液体是放热过程,焓变为负值,则正确的表达为:H2O(g)?H2O(l)△H=-40.69kJ•mol-1,故①错误;
②、含有固体MgCO3的溶液中,是饱和溶液,Mg2+离子和CO32-离子都能水解,水解后离子浓度可能不相等,但在相同的温度下,溶度积常数不变,故②正确;
③、因为苯环中的碳碳键是介于单双键之间的一种独特的键,不存在典型的碳碳双键和碳碳单键,不能用以上表中进行计算,故③错误;
④、NH3•H2O溶液中存在电离平衡,加入少量NH4Cl晶体,NH4+浓度增大使电离平衡向逆方向移动,电离程度降低,溶液的pH减小,故④正确.
故选:D.
点评 本题考查反应热、沉淀的溶解平衡、电离平衡等问题,本题易错点为③项,注意苯的结构特点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入NaOH的溶液,加热,冷却后加入AgNO3溶液 | |
| B. | 加入NaOH溶液,加热,冷却后加入足量稀硝酸酸化,再加入AgNO3溶液 | |
| C. | 在氯乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红葡萄酒密封储存时间越长,质量越好,原因之一是贮存过程中生成了有香味的酯 | |
| B. | 透过观察颜色容易区分黄金与铜锌合金 | |
| C. | 乙烯的产量可以用来衡量一个国家的石油化工发展水平 | |
| D. | 燃料电池是一种高效、环境友好的发电装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量开发利用深海可燃冰,有助于海洋生态环境的治理 | |
| B. | 汽车尾气中含有大量大气污染物,其原因是汽油不完全燃烧造成的 | |
| C. | 煤炭燃烧过程安装固硫装置,目的是提高煤的利用率 | |
| D. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 小苏打是一种膨松剂,可用于制作馒头和面包 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 次氯酸钠溶液可用于环境的消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
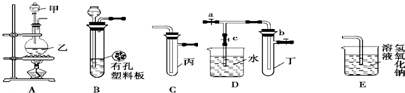
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )
在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )| A. | 固体F中含有配位键 | B. | D和E分子间均可形成氢键 | ||
| C. | A、B、C三种分子均属于非极性分子 | D. | E分子中中心原子的杂化类型为sp2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CH2CH2CH2OH | B. | 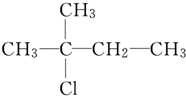 | ||
| C. | 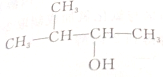 | D. | 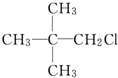 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com