
分析 根据n=$\frac{m}{M}$计算二者物质的量之比,相同条件下,气体体积之比等于其物质的量之比,气体密度之比等于相对分子质量之比,分子数目之比等于物质的量之比.
解答 解:根据n=$\frac{m}{M}$可知,相同质量A、B的物质的量之比为MB:MA,相同条件下,气体体积之比等于其物质的量之比,则标准状况下A与B的体积比为MB:MA,相同条件下,气体密度之比等于相对分子质量之比,故A与B的密度之比为MA:MB,由N=nNA可知,A、B分子数目之比为MB:MA,
故答案为:MB:MA;MA:MB;MB:MA.
点评 本题考查物质的量有关计算、阿伏伽德罗定律及其推论,比较基础,注意对公式的理解与灵活应用.


科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| B. | 合成氨工业中使用催化剂,以提高NH3的产量 | |
| C. | 红棕色的NO2加压后颜色先变深再变浅 | |
| D. | CO2(g)?CO2(aq)△H<0,降温增压可增大二氧化碳气体在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与四氯化碳分子都是含有极性键的极性分子 | |
| B. | 甲烷与四氯化碳分子内的键角均为60° | |
| C. | 甲烷分子比四氯化碳稳定,因为C-H键键能比C-Cl键大 | |
| D. | 甲烷沸点低于四氯化碳,因为C-H键键长比C-Cl键短 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
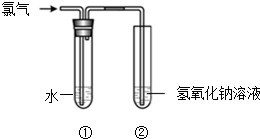 某同学用图所示装置制取氯水并进行相关实验.
某同学用图所示装置制取氯水并进行相关实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l) | B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) | ||
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) | D. | 2H2(g)+O2(g)═2H2O(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
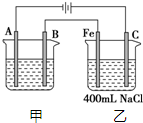 如图所示为相互串联的甲、乙两电解池.试回答:
如图所示为相互串联的甲、乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑦ | B. | ①②④⑤ | C. | ②③④⑤ | D. | ①②⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com