
| △c |
| t |
| △c |
| t |
| ||
| 2 |
| 1 |
| 2 |
| 0.42×0.42 |
| 0.43×0.8 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
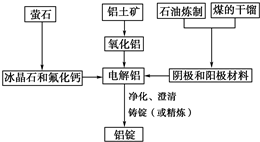
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.粉末中一定有Na20、Na202、NaHC03 |
| B、.粉末中一定不含有Na2C03和NaCl |
| C、粉末中一定不含有Na20和NaCl |
| D、.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中的①、②、③、④分别是几种常见漏斗的上部,A、B、C、D分别是实际操作(分液、制气、向容器中加液体试剂等)时,各漏斗的下部插入容器中的示意图.请根据实际使用操作时上述漏斗的使用范围和它们形状,下列哪一种匹配是不合适的( )
如图中的①、②、③、④分别是几种常见漏斗的上部,A、B、C、D分别是实际操作(分液、制气、向容器中加液体试剂等)时,各漏斗的下部插入容器中的示意图.请根据实际使用操作时上述漏斗的使用范围和它们形状,下列哪一种匹配是不合适的( )| A、制备二氧化碳:A与 ③ |
| B、过滤:B与 ④ |
| C、用双氧水和二氧化锰制氧气:C与 ① |
| D、添加酒精:D与 ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入几滴CuSO4溶液 |
| B、加入少量6mol/L的稀盐酸 |
| C、升高温度 |
| D、不用稀硫酸,改用浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该化合物属于烃 |
| B、该化合物中碳、氢原子个数比为1:2 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述反应是置换反应 |
| B、上述反应是放热反应 |
| C、上述反应中无水CuSO4表现了还原性 |
| D、加热且无水条件下,Na可以与CuSO4反应并生成Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com