
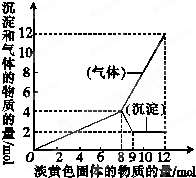
 (1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.
(1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.| 1 |
| 2 |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 起始状态(mol) | 平衡时HBr 物质的量(mol) | ||
| H2 | Br2 | HBr | ||
| 已知 | 1 | 2 | 0 | a |
| ① | 2 | 4 | 0 | |
| ② | 1 | 0.5a | ||
| ③ | m | n(n≥2m) | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
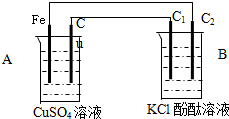 按如图装置进行实验,并回答下列问题:
按如图装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水中可以得到NaCl,电解熔融NaCl 可制备Cl2和Na |
| B、海水蒸发制海盐的过程中只发生了化学变化 |
| C、海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| D、利用潮汐发电是将化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3 (Na2CO3) |
| B、NaCl(NaOH) |
| C、Fe2O3(MgO) |
| D、FeCl3(FeCl2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2molA+2molB |
| B、1molD+2molC |
| C、2molD+1molA+1molB |
| D、1molA+0.5molB+0.5molC+1.0molD |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,某溶液中由水电离的c(OH-)=10-3 mol/L,则该溶液可能为NH4Cl或NaOH溶液 |
| B、常温时浓度均为1 mol/L的KHCO3和K2CO3溶液中,由水电离的c(OH-)前者大于后者 |
| C、1 mL pH=1的H2SO4与100 mLNaOH溶液混合后pH=7,则原NaOH溶液pH=11 |
| D、25℃时pH=5的CH3COOH溶液和100℃时pH=5的AlCl3溶液c(H+)相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com