
| A. | $\frac{3}{4}$dm3 | B. | $\frac{1}{2}$dm3 | C. | $\frac{1}{4}$dm3 | D. | 全满 |
分析 容器中的气体相对氧气的密度为0.625,则气体的平均相对分子质量为0.625×32=20,设氨气的体积分数为x,则空气的体积分数为(1-x),根据平均相对分子质量计算x的值,进而计算氨气的体积,氨气的体积即为进入容器中液体的体积.
解答 解:容器中的气体相对氧气的密度为0.625,则气体的平均相对分子质量为0.625×32=20,
设氨气的体积分数为x,则空气的体积分数为(1-x),则:
17x+29(1-x)=20,
解得:x=0.75,
故氨气的体积为1dm3×0.75=0.75dm3,
即为进入容器中液体的体积0.75dm3,
故选A.
点评 本题考查阿伏伽德罗定律及推论、化学计算等,难度中等,根据平均相对分子质量计算HCl的体积分数是关键,试题培养了学生的分析能力及化学计算能力.


 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答: .
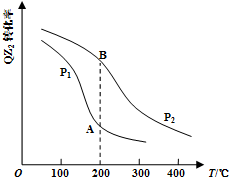
.| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只能含离子键,不能有共价键 | |
| B. | 所有非金属之间形成的化学键一定是共价键 | |
| C. | 电子数相同的两种微粒一定是同一元素 | |
| D. | 化学变化一定有化学键的断裂和形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ②和③ | C. | 只有④ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 96% | B. | 48% | C. | 9.6% | D. | 56% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
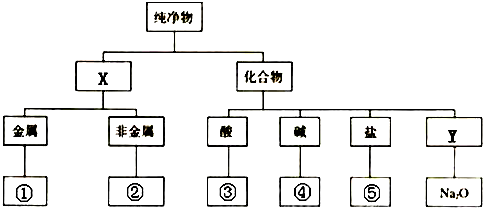
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com