
【题目】CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为﹣24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂. Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓) ![]() CH3Cl+H2O.具体步骤如下:
CH3Cl+H2O.具体步骤如下:
①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集.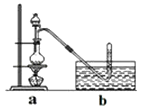
请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是 .
(3)实验室为何用排水法收集CH3Cl?
(4)Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化.现有四只洗气瓶;分别盛有以下试剂: A.1.5%KMnO4(H+)溶液; B.蒸馏水;C.5%Na2SO3溶液; D.98%H2SO4
为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶(填洗气瓶编号),如果观察到则证实上述资料的正确性.
(5)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):
(6)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛的洗气瓶.
(7)某小组同学取VmL被CH3Cl污染的水样与锥形瓶中,用0.10molL﹣1酸性KMnO4溶液进行滴定,实验所得数据如表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.02 | 20.00 | 19.98 |
第一次实验数据出现异常,造成这种异常的原因可能是(填字母代号).
a.锥形瓶洗净后未干燥 b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定过程中振荡锥形瓶时有液体溅出 d.滴定终点时仰视读数.
【答案】
(1)在干燥的HCl气氛中加热
(2)增大盐酸的量以提高甲醇的转化率
(3)CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体
(4)BAC;A紫色褪去
(5)10CH3Cl+14MnO4﹣+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32﹣+Cl2+H2O=SO42﹣+2Cl﹣+H+
(6)乙醇
(7)bd
【解析】解:Ⅰ.(1)在加热ZnCl2晶体时可选择通HCl气体抑制其水解,所以答案是:在干燥的HCl气氛中加热;(2)为了提高甲醇的利用率,可以适当增加盐酸的量,所以答案是:增大盐酸的量以提高甲醇的转化率;(3)因CH3Cl中混有易溶于水的杂质气体,用排水法可以即除杂又可收集,所以答案是:CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体;Ⅱ.(1)如果CH3Cl能被强氧化剂酸性高锰酸钾氧化,可选择先通过盛有水的洗气瓶除去可能混合有的HCl和甲醇,再通过盛有的酸性高锰酸钾洗气瓶,溶液的紫色会褐去,最后通过盛Na2SO3的洗气瓶吸收生成的氯气防污染,所以答案是:BAC;A紫色褪去;(2)酸性高锰酸钾氧化CH3Cl会生成CO2和Cl2 , 同时自身被还原成Mn2+ , 发生反应的离子方程式为10CH3Cl+14MnO4﹣+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O,生成的氯气经过Na2SO3的洗气瓶会氧化Na2SO3为Na2SO4 , 发生反应的离子方程式为SO32﹣+Cl2+H2O=SO42﹣+2Cl﹣+H+ , 所以答案是:10CH3Cl+14MnO4﹣+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32﹣+Cl2+H2O=SO42﹣+2Cl﹣+H+;(3)CH3Cl易溶于乙醇和丙醇等有机溶剂,可选择酒精吸收CH3Cl的尾气,所以答案是:乙醇;(4)a.锥形瓶洗净后未干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)= ![]() 分析,c(标准)不变,故a错误;
分析,c(标准)不变,故a错误;
b.酸式滴定管用蒸馏水洗净后未用标准液润洗,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)= ![]() 分析,c(标准)偏大,故b正确;
分析,c(标准)偏大,故b正确;
c.滴定过程中振荡锥形瓶时有液体溅出,造成V(标准)偏小,根据c(待测)= ![]() 分析,c(标准)偏小,故c错误;
分析,c(标准)偏小,故c错误;
d.滴定终点时仰视读数,造成V(标准)偏大,根据c(待测)= ![]() 分析,c(标准)偏大,故d正确;
分析,c(标准)偏大,故d正确;
故选bd.


科目:高中化学 来源: 题型:
【题目】如图所示,有关化学反应和能量变化的说法正确的是( )

A. 图a表示的是吸热反应的能量变化
B. 图a一定需要加热才能发生,图b不加热也能发生
C. 图b中反应物比生成物稳定
D. 图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
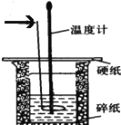
(1)箭头所指的仪器名称为______________________________。
(2)上图所示实验装置存在着一处错误,这处错误是_______________。
(3)若某同学实验中改用60 mL 0.50 mol·L-1稀硫酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热_______________(填“相等”或“不相等”)。
(4)若某同学用改正后的装置做实验,造成测得中和热的数值偏低,请你分析可能的原因是________。
A.做本实验的当天室温较低
B.在量取盐酸时俯视刻度线
C.在量取氢氧化钠溶液时仰视刻度线
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.测量盐酸的温度后,温度计没有用水冲洗干净就去测量氢氧化钠溶液的温度
F.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)化合物H是一种用于合成γ﹣分泌调节剂的药物中间体,其合成路线流程图如下: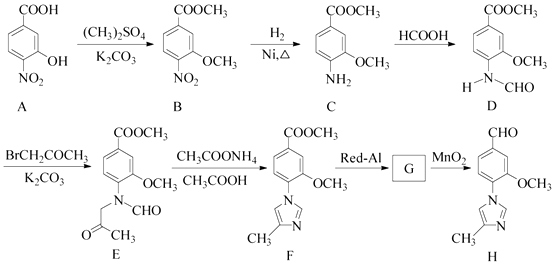
(1)C中的含氧官能团名称为和 .
(2)D→E 的反应类型为 .
(3)写出同时满足下列条件的C的一种同分异构体的结构简式: .
①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,水解产物之一是α﹣氨基酸,另一水解产物分子中只有2种不同化学环境的氢.
(4)G 的分子式为C12H14N2O2 , 经氧化得到H,写出G的结构简式: .
(5)已知: 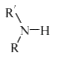
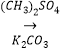
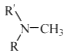 (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以 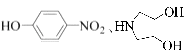 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备 ![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图1: 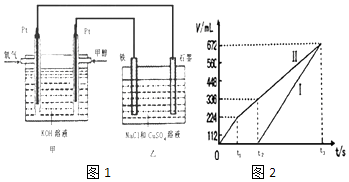
(1)写出甲中通入甲醇这一极的电极反应式 .
(2)理论上乙中两极所得气体的体积随时间变化的关系如图2所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式,原混合溶液中NaCl的物质的量浓度为mol/L.(设溶液体积不变)
(3)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为g.
(4)已知草酸H2C2O4为弱酸. ①常温下,下列事实能说明草酸是弱电解质的是 .
A.向草酸钠溶液加酚酞,溶液变红
B.取一定量草酸溶液加水稀释至10倍,pH变化小于1
C.草酸能使酸性KMnO4溶液褪色
D.取相同pH的草酸溶液和盐酸,分别加入足量的大小、形状相同的镁条,草酸溶液反应速度快
②常温下,0.1molL﹣1的草酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC2O4)+2c(C2O42﹣)=(用准确的数学表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.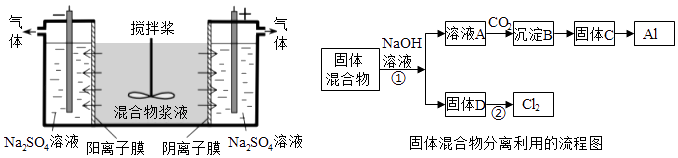
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .
a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .
Ⅱ含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.由分子构成的物质中一定含有共价键
B.正四面体结构的分子中键角一定是109028’
C.形成共价键的元素不一定是非金属元素
D.CO2 和SiO2都是直线型分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示化合物的说法不正确的是( ) 
A.该有机物的分子式为C15H18O4
B.1mol该化合物最多可以与2molNaOH反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com