


分析 (1)浓盐酸与二氧化锰在加热条件下反应生成氯化锰、氯气和水;二氧化锰只能与浓盐酸反应,与稀盐酸不反应;
(2)根据离子的浓度来分析平衡移动;
(3)氯气密度大于空气密度,能溶于水,据此选择收集装置;
(4)氯气有毒,直接排放能够引起空气污染,应进行尾气处理;
(5)氯气易溶于四氯化碳,四氯化碳的密度大于水,所以氯气的四氯化碳层在氢氧化钠溶液下层,可以吸收过量的氯气;
(6)氯气与水反应生成盐酸和次氯酸,反应为可逆反应,盐酸能够与碳酸钙反应,消耗氢离子,使平衡正向移动;
(7)氯水中存在平衡移动,依据化学平衡移动原理,可知盐酸能够与碳酸钙反应,消耗氢离子,使平衡正向移动,HClO浓度大,漂白效果好;
(8)氯水中含盐酸、次氯酸,由③可知滤液中溶质加热,看到溶液变浑浊且有大量无色气体产生为CO2,以此解答.
解答 解:(1)浓盐酸与二氧化锰在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
HCl的物质的量为0.1L×12mol/L=1.2mol,假设HCl完全反应,由方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知生成氯气的物质的量为1.2mol×$\frac{1}{4}$=0.3mol,被氧化的氯化氢的物质的量为0.3mol×2=0.6mol,由于随反应进行,浓盐酸变为稀盐酸,而二氧化锰不与稀盐酸反应,故被氧化的氯化氢的物质的量小于0.6mol,故选:A;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;A;
(2)氯气溶于水发生Cl2+H2O?H++Cl-+HClO,而HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2+H2O?H++Cl-+HClO起到抑制作用,则可利用饱和NaCl溶液除去Cl2中HCl气体,
故答案为:HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2+H2O?H++Cl-+HClO起到抑制作用;
(3)氯气密度大于空气密度,能溶于水,所以应选择向上排空气法收集,D装置的作用是:收集氯气;
故答案为:收集氯气;
(4)氯气有毒,直接排放能够引起空气污染,应进行尾气处理,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液进行尾气处理;
故答案为:吸收过量的氯气;
(5)氯气易溶于四氯化碳,四氯化碳的密度大于水,所以氯气的四氯化碳层在氢氧化钠溶液下层,可以吸收过量的氯气;
故答案为:氯气易溶于四氯化碳,四氯化碳的密度大于水,所以氯气的四氯化碳层在氢氧化钠溶液下层,可以吸收过量的氯气;
(6)氯气与水反应生成盐酸和次氯酸,反应为可逆反应,方程式:Cl2+H2O?H++Cl-+HClO,盐酸能够与碳酸钙反应,消耗氢离子,使平衡正向移动,氯气完全反应,所以浅黄绿色会退去;
故答案为:氯气与水反应生成盐酸和次氯酸,反应为可逆反应,方程式为Cl2+H2O?H++Cl-+HClO,盐酸能够与碳酸钙反应,消耗氢离子,使平衡正向移动,氯气完全反应;
(7)氯水中存在平衡移动,碳酸钙消耗了氯水中的H+,使Cl2+H2O?H++Cl-+HClO平衡正向移动,HClO浓度大,漂白效果增强,
故答案为:碳酸钙消耗了氯水中的H+,使Cl2+H2O?H++Cl-+HClO平衡正向移动,HClO浓度大,漂白效果增强;
(8)氯水中含盐酸、次氯酸,由③可知滤液中溶质加热,看到溶液变浑浊且有大量无色气体产生为CO2,则②的滤液中的溶质除CaCl2、HClO外,还含有Ca(HCO3)2,
故答案为:Ca(HCO3)2.
点评 本题考查了氯气的制备、氯水的性质检验,明确氯气制备原理及氯气成分是解题关键,注意化学平衡移动原理的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
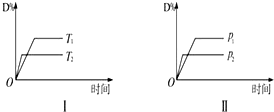 对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )
对于可逆反应mA(g)+nB(s)?pC(g)+qD(g)反应过程中,其他条件不变时,D的百分含量与温度(T)或压强(P)关系如图所示,反应达平衡后,下列叙述正确的是( )| A. | 升高温度,平衡正移 | |
| B. | 使用催化剂,D的百分含量增加 | |
| C. | m<p+q | |
| D. | B的颗粒越小,反应速率越快,有利于平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2>△H3 | B. | △H1>△H3>△H2 | C. | △H3>△H2>△H1 | D. | △H2>△H1>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应属于取代反应,CPAE含有三类官能团 | |
| B. | CPAE的分子式为C17H16O4 | |
| C. | 苯乙醇属于醇类,含有苯环的醇类同分异构体有四种 | |
| D. |  与咖啡酸互为同分异构体 与咖啡酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有21.6g由CO和CO2组成的混合气体,在标况下其体积为13.44L.回答下列问题:
现有21.6g由CO和CO2组成的混合气体,在标况下其体积为13.44L.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4L Cl2与足量NaOH溶液反应生成NaCl和NaClO,转移电子数为Na | |
| B. | 16g甲烷中含有的非极性共价键键数为4Na | |
| C. | 一定两点额SO2溶于水后形成pH为2的水溶液,其中H+的数目为0.01Na | |
| D. | 1.8gD2O中含有的质子数为2Na |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ------ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com