
【题目】南欧紫荆是一种耐碱抗寒的绿化植物,其细胞液浓度很高,有利用根从周围土壤中吸收水分.该植物根细胞中含量最多的物质是( )
A. 蛋白质B. 脂质C. 水D. 无机盐
科目:高中化学 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元
酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1mol H2O的质量为18g/mol
B.40gNaOH溶解在1L水中,形成溶液溶质的物质的量浓度为1mol/L
C.3.01×1023个SO2分子质量为32 g
D.标准状况下,1mol任何物质体积均为22.4L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种酸,草酸晶体(H2C2O42H2O)易溶于水,熔点较低,加热会熔化、气化和分解。草酸(H2C2O4)与氢氧化钙的反应:H2C2O4+Ca(OH)2=CaC2O4↓(白色)+2H2O。
(1)草酸的水溶液的pH___7(填“>”、“=”、“<”)
(2)实验室可用加热草酸晶体分解的方法获得CO。
①先加热草酸晶体生成CO、CO2和H2O,其化学方程式是____;
②最后用图1装置收集CO,气体应从___端进入(选填“a”或“b”)。
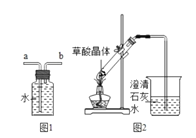
(3)实验图2中观察到澄清石灰水变浑浊,乙认为一定是由草酸晶体受热分解产生的CO2所导致,丙认为乙的结论不严密,理由是___。
按图3装置将草酸钙晶体(H2C2O4xH2O)样品高温加热,使其完全分解。

(4)B中观察到硫酸铜变蓝,说明反应生成了_____;
(5)C、G中澄清石灰水均变浑浊,说明反应还生成___和___气体。
(6)反应开始前通入氮气的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 1molH2和1molI2在加热条件下充分反应,生成HI的分子数为2NA
B. 10g质量分数为46%的乙醇溶液含有的氢原子数目为0.6NA
C. 20mL0.1 mol/LAlCl3溶液中,水解形成Al(OH)3胶体粒子数为0.002NA
D. 0.1molNa2O2和Na2O的混合物中含有的离子总数等于0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液
②向红砖粉末中加入盐酸,充分振荡反应后取上层清液于试管中,滴加KSCN溶液23滴,溶液呈红色,但不一定说明红砖中含有氧化铁
③Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
④制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
⑤向一定量的Cu、Fe2O3的混合物中加入300 mL1.mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含有Fe3+。若用过量的CO在高温下还原相同质量的此混合物,固体减少的质量为2.4g
⑥磁性氧化铁溶于稀硝酸的离子方程式为3Fe2++4H++NO3-=== Fe3++NO↑+3H2O
⑦氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+H+=Fe3++3H2O
⑧Fe2O3不可与水反应得到Fe(OH)3,但能通过化合反应制取Fe(OH)3
⑨赤铁矿的主要成分是Fe3O4,Fe3O4为红棕色晶体
A. ①④⑦ B. ⑤⑧ C. ②③⑥ D. ⑤⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
A. 
微生物燃料电池,可将工业废水中的乙胺(CH3CH2NH2)转化成环境友好的物质(M、N均为铂电极),N电极的电极反应式为2CH3CH2NH2+8H2O-30e-== 4CO2↑+N2↑+30H+
B. 
反应xA(g)+yB(g) ![]() zC(g)的ΔH>0,当n(A)/n(B)=2时,A、B的转化率之比为2:1
zC(g)的ΔH>0,当n(A)/n(B)=2时,A、B的转化率之比为2:1
C. 
恒温恒容条件下,发生的可逆反应2NO2(g) ![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
D. 
利用N2O4制备N2O5的装置(隔膜只允许H+通过,不允许H2O分子通过),其阳极的电极反应式为N2O4+2HNO3 —2e-== 2N2O5+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素在自然界中都以典型的盐类存在,包括氟、氯、溴、碘和砹五种元素,位于元素周期表的第ⅦA族,其中氯、溴和碘主要来之海水。卤素元素在生产实际中承担着重要角色。请回答下列问题:
(1)将经过验纯的氢气点燃,伸入盛有氯气的集气瓶中,在集气瓶口可观察到的现象是_________。
(2)欲检验Na2CO3、Na2SO4、NaCl的混合溶液中的Cl-,正确的操作方法是_____________。
(3)海水晒盐所获取的粗盐,经过提纯、精制之后,其水溶液进行电解,可以得到重要的化工原料。请写出该电解反应的离子方程式______。海带中提取碘时,将海带烘干、灼烧目的是_____、_____。
(4)将0.01 molCl2通入含0.03 molNaBr和0.03 molKI的混合液中,发生反应的离子方程式为_____;再将所得溶液分为两等份,其中一份蒸干、灼烧,最后得到的固体的成分一定有KCl,还有___;另一份再加入少量CCl4,振荡,则CCl4层的颜色是____,分离CCl4层和水层的操作名称是__,需要使用的玻璃仪器除烧杯外,还有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄钠铁钒渣主要含有Na2Fe6(SO4)4(OH)12、BaSO4、NiSO4、MgSO4、CaSO4、Al2(SO4)3等,利用其制备镍锌铁氧体工艺流程如下。

已知:①锌、铝两种元素化学性质相似;②晶体完整度与晶体中Ni、Zn、Fe比例有关;③常温下,相关物质的pKsp单如下表:
![]()
(1)“焙烧”中无烟煤的作用为___________.
(2)“调pH”时,a值可取___________(填标号)。
A.3.2 B.4.3 C.5.2 D.9.1
(3)若“净化”后的溶液中c(M2+)=1.0×10-3mol·L-1,则c(Ca2+)=___________ mol·L-1。
(4)“水热合成”发生反应的离子方程式为___________,滤液的主要成分为___________(填化学式)
(5)由右图可知,pH=8时“水热合成”所得镍锌铁氧体晶体的完整度最高,其原因是___________。
(6)“焙烧”会生成少量BaS,对该工艺造成的影响是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com