
(9分) 右图所示水槽中试管内有一枚铁钉,放置数天后观察:
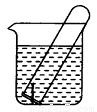
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。(填化学腐蚀或电化学腐蚀)
(2)若试管内液面上升,则原溶液呈 性,发生 腐蚀,正极反应式为 。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀,正极反应式为 。
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案科目:高中化学 来源: 题型:阅读理解
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 浓硫酸 |
| 170摄氏度 |
| 加热 |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
| 加热 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源:2012届山东省济南市高三12月月考化学试卷 题型:填空题
(9分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
| 化学方程式 | K (T1 ) | K (T2) |
F2+H2  2HF 2HF | 1.8 × 1036 1036 | 1.9 ×1032 |
Cl2+H2  2HCl 2HCl | 9.7 ×1012 | 4.2 ×1011 |
Br2+H2  2HBr 2HBr | 5.6 ×107 | 9.3 ×106 |
I2+H2  2HI 2HI | 43 | 34 |
 态
态查看答案和解析>>
科目:高中化学 来源:2012届山东省诸城繁华中学高三下学期假期学习效果检测考试化学试卷 题型:填空题
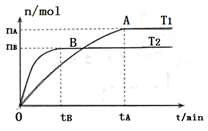
(9分)(1)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率
v (H2)=________________
②分析右图所示图像,下列说法正确的是_________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(2) 加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(3) 在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式 、 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省南京市四校高三12月月考化学试卷 题型:填空题
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ▲ ;砷与溴的第一电离能较大的是 ▲ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 ▲ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为 ▲ ,As原子采取 ▲ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 ▲ 个Ga相连,As与Ga之间存在的化学键有 ▲ (填字母)。
A.离子键 B.σ键 C.π键  D.氢键 E.配位键 F.金属键 G.极性键
D.氢键 E.配位键 F.金属键 G.极性键
B.某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下:
有关物质的部分物理性质如下:
| | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯甲醛 | —26 | 179 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 | 122 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 | -15.3 | 205.0 | 稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 | -116.2 | 34.5 | 微溶于水,易溶于乙醇 |
 萃取的效果 ▲ (填“好”或“差”)。
萃取的效果 ▲ (填“好”或“差”)。 馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代
馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代 号)。
号)。 冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三下学期假期学习效果检测考试化学试卷 题型:填空题
(9分)(1)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率
v (H2)=________________
②分析右图所示图像,下列说法正确的是_________(填序号)

a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(2) 加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(3) 在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com