
| A. | 等物质量的H2O和CO2所含原子数均为3NA | |
| B. | 1mol由Na2O和Na2O2组成的混合物中,含有的离子数为3.5NA | |
| C. | 1L 12mol•L-1浓盐酸和足量MnO2在加热条件下充分反应,生成的气体的分子数为3NA | |
| D. | 标准状况下,6.72L NO2通入足量的水中,转移的电子数为0.2NA |
分析 A.没有告诉二者的物质的量,无法计算含义的原子数;
B.过氧化钠中含有的阴离子为过氧根离子,1mol氧化钠和过氧化钠的混合物中含有3mol离子;
C.浓盐酸与二氧化锰的反应中,浓盐酸变成稀盐酸后反应停止,则反应生成的氯气的物质的量减少;
D.标准状况下6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1molNO,转移了0.2mol电子.
解答 解:A.没有告诉H2O和CO2的物质的量,无法计算二者含义的原子数,故A错误;
B.1mol由Na2O和Na2O2组成的混合物中含有2mol钠离子和1mol由氧离子和过氧根离子组成的阴离子,总共含有3mol离子,含有的离子数为3NA,故B错误;
C.1L 12mol•L-1浓盐酸中含有12molHCl,由于稀盐酸不与二氧化锰反应,则12molHCl不会完全反应,所以生成的氯气的物质的量小于3mol,生成的气体的分子数小于3NA,故C错误;
D.标准状况下6.72L二氧化氮的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1molNO,反应中转移了0.2mol电子,转移的电子数为0.2NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量、气体摩尔体积之间的关系为解答关键,C为易错点,注意稀盐酸不与二氧化锰反应.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
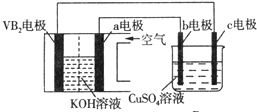
| A. | 电解过程中,c电极表面先有红色物质析出,后有气泡产生 | |
| B. | 外电路中电子由c电极流向VB2电极 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 液态氯化氢不导电,说明它是共价化合物 | |
| B. | 若电解质溶液中分子和离子同时存在,电离方程中只能采用“?”表示 | |
| C. | 相同条件下,强电解质溶液的导电性一定比弱电解质溶液强 | |
| D. | 物质导电的本质是存在自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列说法中,正确的是( )
A.化学反应速率是指一定时间内任何一种反应物的物质的量的减少或任何一种生成物物质的量的增加
B.化学反应速率为0.8mol·L—1·s—1是指1秒钟时某物质的浓度为0.8mol·L—1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越快,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 乙烷(乙烯) | 溴水 | 分液 |
| B | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| C | 乙醇(少量水) | CaO | 蒸馏 |
| D | 乙醇(苯酚) | 适量的溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH小于5.6的降雨称为酸雨 | |
| B. | 充分利用太阳能有助于“节能减排” | |
| C. | 在燃煤中加入适量石灰石,有助于环境保护 | |
| D. | 含磷洗涤剂易被细菌分解,不会导致水体污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com