
铜与稀硫酸不反应,某校实验小组的同学在老师的指导下设计了下列装置,实现了铜与稀硫酸的反应。请回答下列问题:
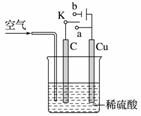
(1)甲同学认为在通入空气的同时,将开关K与______(填“a”或“b”)连接,即可实现。则此时石墨电极的反应式为__________________,电池的总反应式为________________________。电池工作时,H+向________(填“C”或“Cu”)极移动。
(2)乙同学认为,不通入空气,将K与______(填“a”或“b”)连接,也可以实现。则Cu极的电极反应式为________________________,总反应的离子方程式为________________________。若标准状况下产生2.24 L气体,则电路中转移的电子为______mol。
(3)丙同学认为还可以用如图所示装置模拟工业上电镀铜。他认为只要将C换成Fe(Cu足量),并将乙同学的实验持续足够长时间,即可实现在Fe上镀Cu。你认为他的想法______(填“正确”或“不正确”),理由是______________。这种方法得到的铜镀层______(填“牢固”或“不牢固”),理由是________________________。
答案 (1)a O2+4H++4e-===2H2O
2Cu+O2+2H2SO4===2CuSO4+2H2O C
(2)b Cu-2e-===Cu2+
Cu+2H+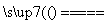 Cu2++H2↑ 0.2
Cu2++H2↑ 0.2
(3)正确 阴、阳极及电解质溶液都符合电镀的要求 不牢固 在电镀过程中会有氢气生成,导致镀层中有气泡
解析 (1)通入空气,即用氧气作氧化剂,将铜氧化,故应通过原电池实现,则应将K与a相连,此时Cu为负极,发生反应:Cu-2e-===Cu2+;C为正极,发生反应:O2+4H++4e-===2H2O,总反应式为2Cu+O2+2H2SO4===2CuSO4+2H2O。电池工作时,H+向正极(即C极)移动。(2)不通入空气,没有氧化剂,此时要实现Cu被氧化成Cu2+,必须通过电解实现,故应将K与b相连。Cu为阳极,发生反应Cu-2e-===Cu2+;C为阴极,发生反应2H++2e-===H2↑,总反应的离子方程式为Cu+2H+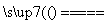 Cu2++H2↑。标准状况下产生2.24 L气体,即0.1 mol,转移的电子为0.2 mol。(3)电解足够长时间后,溶液中的H+完全放电,此时溶液变为CuSO4溶液,Cu作阳极,Fe作阴极,符合电镀原理,可实现电镀。但由于溶液电解过程中,Cu2+的放电能力强于H+的,故实际上H+没有完全放电时即开始电镀,此时可能会同时有H2生成,使形成的铜镀层中有气泡而不牢固。
Cu2++H2↑。标准状况下产生2.24 L气体,即0.1 mol,转移的电子为0.2 mol。(3)电解足够长时间后,溶液中的H+完全放电,此时溶液变为CuSO4溶液,Cu作阳极,Fe作阴极,符合电镀原理,可实现电镀。但由于溶液电解过程中,Cu2+的放电能力强于H+的,故实际上H+没有完全放电时即开始电镀,此时可能会同时有H2生成,使形成的铜镀层中有气泡而不牢固。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
下列各物质中,按熔点由高到低的顺序排列正确的是( )
A.CH4>SiH4>GeH4>SnH4
B.KCl>NaCl>MgCl2>MgO
C.Rb>K>Na>Li
D.金刚石>SiC >Si >S
查看答案和解析>>
科目:高中化学 来源: 题型:
在如图所示的装置中,若通直流电5 min时,铜电极质量增加2.16 g。试回答下列问题。
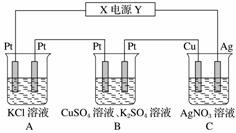
(1)电源中X电极为直流电源的________极。
(2)pH变化:A:________,B:________,C:________(填“增大”、“减小”或“不变”)。
(3)通电5 min时,B中共收集224 mL(标准状况下)气体,溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4)若A中KCl足量且溶液的体积也是200 mL,电解后,溶液的pH为__________(设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
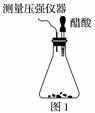
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 醋酸浓度的影响 | 0.5 | 36.0 | |
| ③ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了________(填“氧化”或“还原”)反应,其电极反应式是________________________________________________________________________。

(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:________________________________________________________________________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列说法合理的是( )
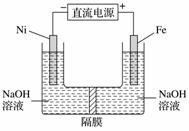
A.铁是阳极,电极反应为Fe-2e-+2OH-===Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.若隔膜为阴离子交换膜,则电解后左侧溶液中含有FeO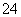
D.每制得1 mol Na2FeO4,理论上可以产生67.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
13C-NMR(核磁共振)可用于含碳化合物的结构分析14N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是
A.13C与15N具有相同的中子数 B.13C与C60是同一种物质
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
关于铯(Cs)及其化合物的性质,说法错误的是
A.金属铯的熔点比金属钠高 B.CsOH比NaOH的碱性强
C.Cs与H2O能剧烈反应,甚至发生爆炸 D.碳酸铯易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈血红色,说明不含Fe2+
B.用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2
C.向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
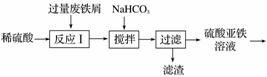
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下。
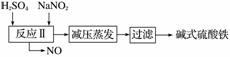
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题。
(1)加入少量NaHCO3的目的是调节pH,使溶液中的______沉淀,该工艺中“搅拌”的作用是__________。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)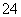 。该水解反应的离子方程式为__________________。
。该水解反应的离子方程式为__________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO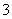 。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A.氯水 B.KSCN溶液
C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com