
【题目】液氨与水性质相似,也存在微弱的电离:2NH3![]() NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2—,其离子积常数K=c(NH4+)·c(NH2—)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
A. 液氨的电离平衡 B. 液氨的离子积常数
C. c(NH4+) D. c(NH2—)
科目:高中化学 来源: 题型:
【题目】如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、C1-)生产CuCl的流程:
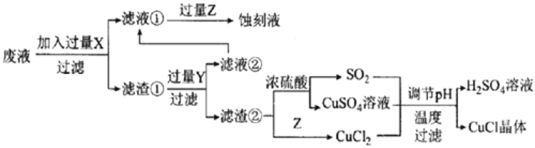
已知:CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化为绿色,见光分解变成褐色。
请回答下列问题:
(1)流程中的滤渣①与Y反应和X与Y反应相比,单位时间内得到的气体多,其原因为____________________________________________。
(2)滤液①需要加过量Z,检验Z过量的方法是______________________。
(3)写出生成CuCl的离子方程式:_________________________________。
(4)为了提高CuCl产品的纯度,流程中的“过滤”操作适宜用下列装置图中的___________(填选项字母),过滤后,洗涤CuCl的试剂宜选用___________(填“无水乙醇”或“稀硫酸”)

(5)CuCl加入饱和NaCl溶液中会部分溶解生成CuCl2-,在一定温度下建立两个平衡:
I. CuCl (s) ![]() Cu +(aq)+Cl- (aq) Ksp=1.4×10-6
Cu +(aq)+Cl- (aq) Ksp=1.4×10-6
II. CuCl(s)+Cl- (aq)![]() CuCl2-(aq) K=0.35。
CuCl2-(aq) K=0.35。
分析c(Cu+)、c(CuCl2-)和Ksp、K的数学关系,在图中画出c(Cu+)、c(CuCl2-)的关系曲线(要求至少标出一个坐标点) ______。

(6)氯化亚铜的定量
①称取样品0.25g于250mL锥形瓶中,加入10mL过量的FeCl3溶液,不断摇动:
②待样品溶解后,加入20mL蒸馏水和2滴指示剂;
③立即用0.1000mol·L-1硫酸铈标准溶液滴定至绿色为终点;
④重复三次,消耗硫酸铈溶液的平均体积为24.30mL。
上述相应化学反应为CuCl+ FeCl3===CuCl2+FeCl2、Fe2++Ce4+===Fe3++Ce3+,则样品中CuCl的纯度为___________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应2NO2(g)![]() 2NO(g)+O2(g),在恒压密闭容器中充入NO2,该反应达到化学平衡状态的标志是( )
2NO(g)+O2(g),在恒压密闭容器中充入NO2,该反应达到化学平衡状态的标志是( )
A.反应停止了
B.NO的正反应速率与O2的逆反应速率相等
C.c(NO):c(O2)=2:1
D.混合气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
![]() 第一份加入
第一份加入![]() 溶液有沉淀产生;
溶液有沉淀产生;
![]() 第二份加足量NaOH溶液加热后,收集到气体
第二份加足量NaOH溶液加热后,收集到气体![]() ;
;
![]() 第三份加足量
第三份加足量![]() 溶液后,得干燥沉淀
溶液后,得干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 根据上述实验,回答下列问题
根据上述实验,回答下列问题
(1)该溶液中一定存在的离子是______,可能存在的离子是______.
(2)求一定存在的离子中阳离子的浓度或浓度的取值范围______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应:3A(g)+2B(g) ![]() xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
xC(g)+2D(g),在2 L密闭容器中,把4 mol A和2 mol B混合,2 min后达到平衡时生成1.6 mol C,又测得反应速率vB=0.2 mol·L-1·min-1,则下列说法中正确的是( )
A. x=3B. B的转化率为20%
C. 平衡时气体压强是原来的0.94倍D. 达到平衡时A的浓度为1.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ![]() 。
。
A.![]() 溶于足量稀
溶于足量稀![]() :
:![]()
B.用食醋检验牙膏中碳酸钙的存在:![]()
C.![]() 酸性溶液放在空气中变质:
酸性溶液放在空气中变质:![]()
D.电解![]() 水溶液的离子方程式: 2Cl-+2H2O
水溶液的离子方程式: 2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯![]() 作为一种高效强氧化剂,已被联合国世界卫生组织
作为一种高效强氧化剂,已被联合国世界卫生组织![]() 列为AⅠ级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中
列为AⅠ级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中![]() 的质量分数高于
的质量分数高于![]() 等均有可能引起爆炸,易与碱液反应生成盐和水。
等均有可能引起爆炸,易与碱液反应生成盐和水。
![]() 某研究小组设计如图所示实验制备
某研究小组设计如图所示实验制备![]() 溶液,其反应的化学方程式为
溶液,其反应的化学方程式为![]() 。
。

![]() 在反应开始之前将烧杯中的水加热到
在反应开始之前将烧杯中的水加热到![]() ,然后停止加热,并使其温度保持在
,然后停止加热,并使其温度保持在![]() 之间。控制温度的目的是___________,图中装置中缺少的一种必需的玻璃仪器是_______________________。
之间。控制温度的目的是___________,图中装置中缺少的一种必需的玻璃仪器是_______________________。
![]() 装置A用于溶解产生的二氧化氯气体,其中最好盛放________
装置A用于溶解产生的二氧化氯气体,其中最好盛放________![]() 填标号
填标号![]() 。
。
a.20mL60℃的温水 b.100mL冰水 c.100mL饱和食盐水 d.100mL沸水
![]() 在烧瓶中加入12.25gKClO3和9g草酸
在烧瓶中加入12.25gKClO3和9g草酸![]() ,然后再加入足量的稀硫酸,水浴加热,反应后生成
,然后再加入足量的稀硫酸,水浴加热,反应后生成![]() 的质量为________。
的质量为________。
![]() 用
用![]() 处理过的饮用水
处理过的饮用水![]() 为
为![]() 常含有一定量对人体不利的亚氯酸根离子
常含有一定量对人体不利的亚氯酸根离子![]() 。饮用水中
。饮用水中![]() 、
、![]() 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至![]() ;
;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的![]() 溶液滴定至终点;
溶液滴定至终点;
步骤5:再调节溶液的![]() ;
;
步骤6:继续用相同浓度的![]() 溶液滴定至终点。
溶液滴定至终点。
![]() 步骤1中若要量取20.00mL水样,则应选用的仪器是____________________。
步骤1中若要量取20.00mL水样,则应选用的仪器是____________________。
![]() 步骤
步骤![]() 的目的是测定水样中
的目的是测定水样中![]() 的含量,其反应的化学方程式为2ClO2+2KI=2KClO2+I2,2Na2S2O3+I2=Na2S4O6+2NaI,则步骤4中加入的指示剂为______________,滴定达到终点时溶液的颜色变化为______________。
的含量,其反应的化学方程式为2ClO2+2KI=2KClO2+I2,2Na2S2O3+I2=Na2S4O6+2NaI,则步骤4中加入的指示剂为______________,滴定达到终点时溶液的颜色变化为______________。
![]() 步骤5的目的是使
步骤5的目的是使![]() 将溶液中的
将溶液中的![]() 还原为
还原为![]() 以测定其含量,该反应的离子方程式为____________________________。
以测定其含量,该反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.价电子排布为ns1的元素,不一定是s区元素
B.配合物Fe(CO)n内中心原子价电子数与配体提供电子总数之和为18,则n=5
C.光卤气(COCl2)、甲醛分子的立体构型和键角均相同
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com