
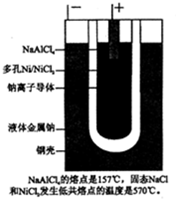
 钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )| A. | 该电池在常温下不能正常工作 | |
| B. | 熔融NaAlCl4不参与正常电极反应 | |
| C. | 正常充电的阴极反应;NaCl+e-=Na+Cl- | |
| D. | 过放电时正极反应:AlCl${\;}_{4}^{-}$-3e-=4Cl-+Al |
分析 钠-氯化镍电池是一种高能电池,放电时,负极材料为金属钠,电极反应为:Na-e-═Na+,正极材料为NiCl2,电极反应为:Ni2++2e-═Ni,电池总反应式为:2Na+NiCl2═Ni+2NaCl.充电时,蓄电池中的负极接电源负极作阴极,电极反应为:Na++e-═Na,蓄电池中的正极接电源正极作阳极,电极反应为:Ni-2e-=Ni2+,以此解答该题.
解答 解:A、固态的氯化钠与NiCl2发生低熔的温度为570℃,所以该电池在常温下不能正常工作,故A正确;
B、熔融NaAlCl4是介质,不参与正常电极反应,故B正确;
C、充电时,蓄电池中的负极接电源负极作阴极,电极反应为:Na++e-═Na,故C正确;
D、熔融NaAlCl4是介质,不参与正常电极反应,故D错误.
故选:D.
点评 本题考查了蓄电池充放电时的电极反应,明确电池的正负极以及发生的反应是解题的关键.难度不大


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:解答题
 A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当通入的Cl2为2.24 L时,反应中电子转移数目为0.1 NA | |
| B. | 当溶液中Na+为0.4 NA时,溶液中的Cl-为0.2 NA | |
| C. | 当电子转移数目为0.2 NA时,溶液质量增加14.2 g | |
| D. | 当溶液质量增加7.1 g时,溶液中ClO-为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”可提高空气质量 | |
| B. | 酸性氧化物均能与水反应生成对应的酸,如CO2、SiO2、SO3 | |
| C. | 石油化工中的裂化、裂解过程都是通过化学反应来获得气态烯烃 | |
| D. | 乙醇、过氧化氢、次氯酸钠等均通过氧化作用达到杀菌消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某研究性小组将一定浓度的NaCO3溶液滴入MgSO4溶液中得到白色沉淀,对于白色沉淀的成分进行研究:
某研究性小组将一定浓度的NaCO3溶液滴入MgSO4溶液中得到白色沉淀,对于白色沉淀的成分进行研究:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cu和足量的硫反应,转移的电子数为nA | |
| B. | 标准状况下,22.4 L氯仿中含有的分子数为nA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1nA | |
| D. | 53.5g NH4Cl中含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com