
| A.C2H2 | B.C2H4 | C.PCl3 | D.BF3 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
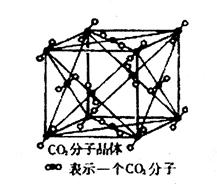
科目:高中化学 来源:不详 题型:填空题
 :
: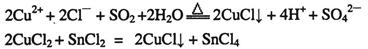
 。
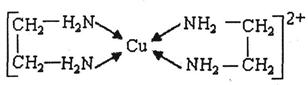
。 中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。
中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。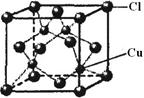
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种分子中心原子的杂化类型不同 |
| B.两种分子中键的极性和分子的极性不同 |
| C.NH3分子中存在有一对未成键的孤对电子 |
| D.氨气分子之间和甲烷分子之间的作用力类型不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2的化学性质比O2稳定 | B.HNO3易挥发,H2SO4难挥发 |
| C.常温、常压下,溴呈液态,碘呈固态 | D.稀有气体很难发生化学反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.红磷与白磷互为同分异构体 |
| B.C3H6与C5H10一定互为同系物 |
| C.HCl、NH3、CO2均是极性分子 |
| D.氯化钠晶体、冰、金刚石是不同类型的晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com