

| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | -69 | 25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | - | 微溶 | 难溶 | |
分析 由制备纯TiCl4的流程示意图,钛精矿与氯气、C发生氯化过程,反应为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,结合表格中数据可知,蒸馏得到纯TiCl4,
(1)①由I.TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol-1
II.2C(s)+O2(g)=2CO(g)△H2=-220.9kJ•mol-1,
结合盖斯定律可知,I+II得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g);
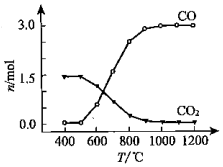
②氯化过程中CO和CO2可以相互转化,温度高时CO的物质的量多、CO2的物质的量少;
③尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,食盐水吸收HCl,氯化亚铁吸收氯气;
④过滤得到粗TiCl4混合液,可能混有反应物中固体物质;
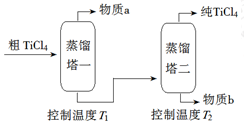
(2)粗TiCl4经两步蒸馏得纯TiCl4,由图及表格数据可知,先分离出SiCl4,后分离出TiCl4.
解答 解:由制备纯TiCl4的流程示意图,钛精矿与氯气、C发生氯化过程,反应为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,结合表格中数据可知,蒸馏得到纯TiCl4,
(1)①由I.TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol-1
II.2C(s)+O2(g)=2CO(g)△H2=-220.9kJ•mol-1,
结合盖斯定律可知,I+II得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g),△H=(+175.4kJ•mol-1)+(-220.9kJ•mol-1)=-45.5kJ•mol-1,
即热化学方程式为TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H=-45.5kJ•mol-1,
故答案为:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H=-45.5kJ•mol-1;
②因温度越高,CO的物质的量越多而CO2的物质的量少,说明CO2生成CO的反应是吸热反应,所以△H>0,
故答案为:>;温度越高,CO的物质的量越多而CO2的物质的量少,说明CO2生成CO的反应是吸热反应;
③尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,食盐水吸收HCl,氯化亚铁吸收氯气生成氯化铁,则尾气的吸收液依次是饱和食盐水、氯化亚铁溶液,
故答案为:饱和食盐水、氯化亚铁溶液;
④由反应可知,氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有TiO2、C,
故答案为:TiO2、C;
(2)粗TiCl4经两步蒸馏得纯TiCl4,由图及表格数据可知,先分离出SiCl4,后分离出TiCl4,则先控制温度T1为58℃左右时分离出物质a为SiCl4,控制温度T2为136℃左右时分离出纯TiCl4,故答案为:SiCl4;136℃左右.
点评 本题考查物质的制备实验,为高频考点,把握流程中发生的反应、混合物分离提纯、发生的反应为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合,题目难度不大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 放电过程 | 充电过程 |
| A | Li+向电池的正极迁移 | 化学能转化成电能 |
| B | 可以加入磷酸以提高电解质的导电率 | 阳极的电极反应式为LiFePO4-e-═FePO4+Li+ |
| C | 若正极增加7g,则有NA个电子经电解质由负极流向正极 | 阳极材料的质量不断减少 |
| D | 若有n molLi+迁移,则理论负极失去nmol电子 | 阴极的电极反应式为Li++e-═Li |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<7 | |
| B. | 该溶液中水电离的c(OH-)=10-amol/L | |
| C. | CH3COO-水解的百分率为$\frac{10-a}{0.1}$×100% | |
| D. | c(CH3COOH)=(l0a-14-10-a)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 (b)、
(b)、 (d)、
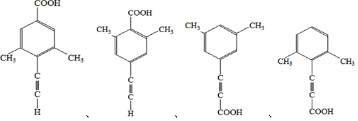
(d)、 (p)的分子式均为C6H6,下列说法正确的是( )
(p)的分子式均为C6H6,下列说法正确的是( )| A. | b的同分异构体只有d和p两种 | |
| B. | b、d、p的二氯代物均只有三种 | |
| C. | b、d、p均可与酸性高锰酸钾溶液反应 | |
| D. | b、d、p中只有b的所有原子处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应①的产物中含有水 | B. | 反应②中只有碳碳键形成 | ||
| C. | 汽油主要是C5~C11的烃类混合物 | D. | 图中a的名称是2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅太阳能电池工作时,光能转化成电能 | |
| B. | 锂离子电池放电时,化学能转化成电能 | |
| C. | 电解质溶液导电时,电能转化成化学能 | |
| D. | 葡萄糖为人类生命活动提供能量时,化学能转化成热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
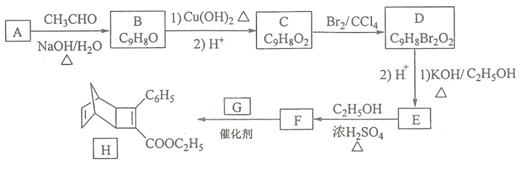
 +
+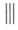 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$
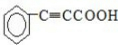 .
.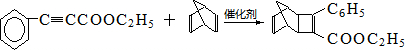 .
. .
.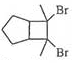 的合成路线
的合成路线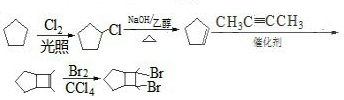 (其他试剂任选).
(其他试剂任选).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com