
| A. | 它不能燃烧 | |
| B. | 它能使酸性高锰酸钾溶液褪色 | |
| C. | 它是一种高分子纯净物 | |
| D. | 它的单体与家用保鲜膜塑料的单体相同 |
分析 A、根据有机物的通性可知,一般的有机物都具有一定 的可燃性;
B、聚乙烯树脂中没有碳碳不饱和键;
C、高分子中的链节的数目可以不同;
D、聚乙烯树脂的单体是乙烯.
解答 解:A、根据有机物的通性可知,一般的有机物都具有一定的可燃性,所以聚乙烯树脂可以燃烧,故A错误;
B、聚乙烯树脂中没有碳碳不饱和键,不以使酸性高锰酸钾溶液褪色,故B错误;
C、高分子中的链节的数目可以不同,所以高分子化合物一般都是混合物,故C错误;
D、聚乙烯树脂的单体是乙烯,家用保鲜膜塑料的单体也是乙烯,故D正确,
故选D.
点评 本题主要考查了聚乙烯树脂的性质,难度不大,注意判断物质的化学性质时要根据其结构确定,聚乙烯中不含双键,此点是易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 粗铜作阳极,其电极反应式:Cu2++2e-=Cu | |
| B. | 电解过程中,电解质溶液中c(Cu2+)不变 | |
| C. | 电解后,阴极上还附有极少量的Fe和Ni | |
| D. | 电解后,可用阳极泥来提炼金、银等贵金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中得到6.72 L的气体(标况) | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(NaCl)=2.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为减缓反应速率,将饱和食盐水滴加到烧瓶中的电石上来制取乙炔 | |
| B. | 实验室制乙烯时应将无水乙醇缓慢加入到浓硫酸中,并加入碎瓷片以防暴沸 | |
| C. | 将浓氨水逐滴加入到2%的硝酸银溶液中至产生的沉淀恰好溶解即制得银氨溶液 | |
| D. | 苯甲酸的重结晶实验中,粗苯甲酸全溶后再加入少量蒸馏水,目的是有利于趁热过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊溶液变红的溶液中:MnO4-、NO3-、SO42-、Na+、SO32- | |
| B. | 加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42- | |
| C. | 使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32- | |
| D. | pH=1的溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,同一时间内阳极溶解铜的质量比比阴极析出铜的质量小 | |
| B. | 高炉炼铁时,增加高炉高度,延长CO和铁矿石的接触时间,可以提高CO利用率 | |
| C. | 硫酸工业中,接触室内安装热交换器,是为了将SO2完全转化为SO3 | |
| D. | 侯氏制碱是将CO2和NH3先后通入饱和氯化钠溶液中得碳酸氢钠固体,再灼烧制碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
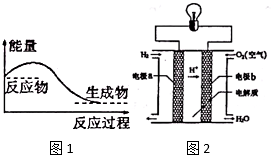 能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com