
【题目】 (1) 2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的 ΔH= -99kJ/mol。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的 ΔH= -99kJ/mol。请回答下列问题:
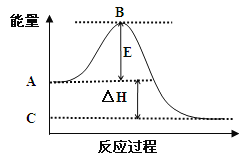
①图中A点表示: ; C点表示: ;
E的大小对该反应的反应热 (填“有”或“无”)影响。
②图中△H= kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式: ;
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
【答案】(1)①反应物的总能量;生成物的总能量;无;-198
(2)①H2 (g) +![]() O2 (g)=H2O ( g ) ΔH =―241.8 kJ/mol ;―286.8 ;―286.8
O2 (g)=H2O ( g ) ΔH =―241.8 kJ/mol ;―286.8 ;―286.8
【解析】(1)①根据图像可知,反应物总能量高于生成物总能量,所以该反应为放热反应,由此可知图中A点表示反应物的总能量;C点表示生成物的总能量;E表示活化能,活化能的大小对该反应的反应热无影响。
②图中表示的是2molSO2的反应,因此△H=-99×2=-198 kJ·mol-1;
(2)①氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量,则反应的热化学方程式
为H2 (g)+![]() O2 ( g )=H2O(g) ΔH =―241.8 kJ/mol;
O2 ( g )=H2O(g) ΔH =―241.8 kJ/mol;
②根据①H2 (g) +![]() O2 (g)=H2O(g) ΔH =―241.8 kJ/mol;②H2O(g)=H2O(l)
O2 (g)=H2O(g) ΔH =―241.8 kJ/mol;②H2O(g)=H2O(l)
△H= —45kJ/mol 。氢气燃烧生成气态水时放出热量为241.8KJ,气态水生成液态水放出热量为45KJ,故氢气的燃烧热为286.8KJ。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的书写及对应表述均正确的是
A.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g 时,放出19.12 kJ 热量。则Fe(s)+S(s)![]() FeS(s) △H=95.6 kJmol1
FeS(s) △H=95.6 kJmol1
B.足量稀醋酸与 0.1 molL1NaOH 溶液反应:H+(aq)+OH(aq) ![]() H2O(l) △H=57.3 kJmol1
H2O(l) △H=57.3 kJmol1
C.已知,1 mol H2完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为:2H2O(l)![]() 2H2(g)+O2(g) △H=285.5kJmol1
2H2(g)+O2(g) △H=285.5kJmol1
D.已知 2C(s)+O2(g)![]() 2CO(g) △H= 221kJmol1,则可知 C 的燃烧热△H=110.5 kJmol1
2CO(g) △H= 221kJmol1,则可知 C 的燃烧热△H=110.5 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物中分离出的化合物 zeylastral 的结构简式如图所示,下列说法不正确的是( ) 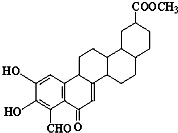
A.该化合物可以发生水解反应
B.该化合物能发生银镜反应
C.该化合物能使酸性KMnO4溶液褪色
D.该化合物共含有四种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池和电解池都能实现能量的置换.回答下列问题:
(1)可将化学能转化为电能是池;
(2)下列反应能设计成原电池的是:
①2FeCl3+Fe═3FeCl2 . Com]
②AlCl3+3NH3H2O═Al(OH)3↓+3NH4Cl
③NaOH+HCl═NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为:
(4)如图装置当闭合电键时,电表显示有电流通过.则Pt极的电极反应式:当甲中产生0.1mol气体时,乙中析出铜的质量应为g. 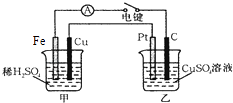
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,克服的微粒间的相互作用力属于同种类型的是( )
A.干冰和氯化铵分别受热变为气体
B.液溴和苯分别受热变为气体
C.二氧化硅和铁分别受热熔化
D.食盐和葡萄糖分别溶解在水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如图所示。

(1)下列有关生物质能的说法正确的是 。
a.生物质能本质上来源于太阳能
b.纤维素水解获得的产物中含有丰富的生物质能
c.生物质“热裂”获得的汽油、柴油等属于纯净物
d.将杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,可作家庭燃气
(2)由生物质能可获得CO和H2。等物质的量的CO与H2反应时,其原子利用率可达100%,则该反应合成的物质可能是 。
a.汽油 b.甲醇(CH4O) c.甲醛(CH2O) d.乙酸(C2H4O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题.
(1)装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 .
(2)装置2中的石墨是极(填“正”或“负”)
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为极;铁电极的电极反应
②停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题.
在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如下: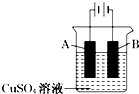
①A电极对应的金属是(写元素名称),B电极的电极反应式是;
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为;
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com