
| A. | 该反应在40 min内的平均速率可表示为 ν(NH3)=0.001 mol/L•min | |
| B. | 该反应达到平衡时,保持其他条件不变,容器中NH3、N2、H2的物质的量保持相等 | |
| C. | 其他条件不变,升高温度,可使该反应的速率加快 | |
| D. | 达到平衡时,ν(NH3)=ν(N2) |
分析 A.反应速率v=$\frac{△c}{△t}$;
B.结合化学平衡三行计算分析判断;
C.升温增大反应速率;
D.反应速率之比等于化学方程式计量数之比,为正反应速率之比.
解答 解:将1mol N2和3mol H2置于1L密闭容器中,在一定条件下发生反应N2+3H2═2NH3(正反应是放热反应),经过40min,该反应达到平衡时,容器中NH3的物质的量为0.4mol,
A.该反应在40 min内的平均速率可表示为 ν(NH3)=$\frac{\frac{0.4mol}{1L}}{40min}$=0.01 mol/L•min,故A错误;
B.N2+3H2═2NH3
起始量(mol) 1 3 0
变化量(mol) 0.3 0.6 0.4
平衡量(mol)0.7 2.4 0.4,
该反应达到平衡时,保持其他条件不变,容器中NH3、N2、H2的物质的量不相等,故B错误;
C.其他条件不变,升高温度,正逆反应速率都增大,所以升温可使该反应的速率加快,故C正确;
D.达到平衡时,ν(NH3)正=2ν(N2)逆,或ν(NH3)逆=2ν(N2)正,故D错误;
故选C.
点评 本题考查了化学反应速率、化学平衡状态判断、反应速率计算等知识点,掌握基础是解题关键,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
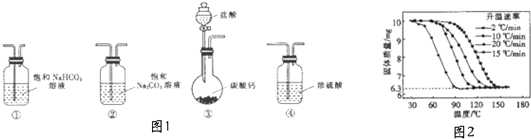
| NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
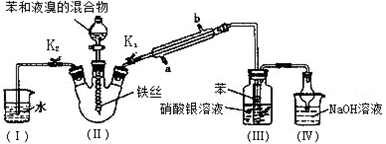
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
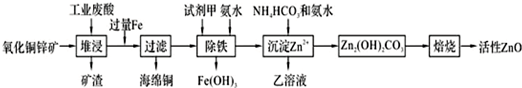
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
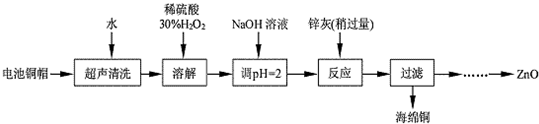
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 1.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
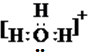 和
和 ;
;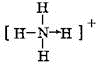 和O=C=O.
和O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
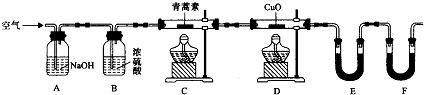
| 装置 | 实验前/g | 试验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠溶解在AlCl3溶液中:2Na+2H2O=2Na++H2↑ | |
| B. | 铝溶解在NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | MgO溶于醋酸中:MgO+2H+=H2O+Mg2+ | |
| D. | Al(OH)3溶于稀硫酸中:OH-+H+=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com