

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
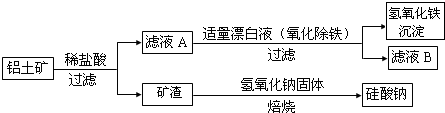
分析 (1)氧化铁属于碱性氧化物,与酸反应生成盐和水;Fe2O3、Al2O3、MgO都和硫酸反应,二氧化硅不和酸反应;
(2)根据原子守恒来配平;
(3)NaOH与Fe2+反应生成的氢氧化亚铁易被氧化;
(4)根据几种离子沉淀的pH,应选择使Fe3+沉淀完全而其他离子不沉淀;因加入的是氢氧化钠来调节PH,所以滤液B中应是未沉淀离子的硫酸盐和硫酸钠.
解答 解:(1)氧化铁与硫酸反应生成硫酸铁和水,反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;
硫酸渣中只有二氧化硅不与稀硫酸反应,所以“滤渣A”主要成份的化学式为SiO2,
故答案为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;SiO2;
(2)FeS2 中的S元素的化合价是-1价,生成物中Fe的化合价是+2价,S的化合价是+6价,整体升高14价,而Fe3+的化合价降低1价,根据升降化合价总数相等,所以Fe3+的系数是14,则SO42-的系数是2,再根据元素守恒和电荷守恒判断生成物中还有氢离子,其系数为16,则水的系数是8,配平后的反应为:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+,
故答案为:8;2;16H+;
(3)Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓;(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3),
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓(或Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3);
(4)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间;
未沉淀的离子为:Na+、Mg2+、Al3+,故滤液B可以回收的物质有:Na2SO4、Al2(SO4)3、MgSO4,
故答案为:3.2~3.8(或之间的数据值);Na2SO4、Al2(SO4)3、MgSO4.
点评 本题通过制备铁红考查了物质制备方案的设计及化学实验基本操作方法的综合应用,题目难度中等,明确制备流程及化学实验基本操作方法为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
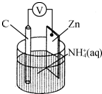
| A. | 碳电极上发生还原反应 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 负极上发生的反应为2NH4++2e-═2NH3↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡后静置 | 下层呈紫红色 | 氧化性:Fe3+>I2 |
| B | 向稀硫酸中加入少量铁粉 | 溶液变为黄色 | 稀硫酸将Fe氧化成Fe3+ |
| C | 向盛Na2SiO3 溶液的试管中滴加1滴酚酞溶液,然后逐滴加入稀盐酸至红色接近消失时停止,静置 | 试管里出现凝胶 | 非金属性:Cl>Si |
| D | 葡萄糖溶液与新制的氢氧化铜混合加热 | 有砖红色沉淀生成 | 葡萄糖分子中有羟基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.
雾霾天气的频繁出现严重影响了我国居民的生活健康.研究显示其中首要污染物为可吸入颗粒物PM2.5,燃煤、机动车和扬尘是造成污染的主要原因.因此,运用化学法防治大气污染是当下重要的研究方向.| 离子 | Na+ | K+ | NH4+ | NO3- | SO42- | Cl- |
| 浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 5×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.
T℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 非极性键也可存在于离子化合物中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com