
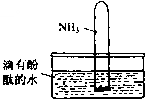
 氨气是一种重要的化工原料,氨态氮肥是常用的肥料.
氨气是一种重要的化工原料,氨态氮肥是常用的肥料.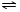 NH3•H2O
NH3•H2O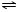 NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色.
NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色.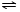 NH3•H2O+H+
NH3•H2O+H+分析 (1)工业合成氨气为工业固氮,正反应为放热反应,升高温度,平衡向吸热过程移动;
(2)达到平衡时,正逆反应速率相等,各物质的浓度、含量不变;
(3)欲使NH3产率增大,应使平衡正向移动,结合v=$\frac{△c}{△t}$以及反应速率之比等于化学计量数之比计算;
(4)氨气易溶于水,溶液呈碱性;
(5)(NH4)2SO4为强酸弱碱盐,水解呈酸性,可结合氨气为碱性气体的特点检验铵根离子.
解答 解:(1)工业合成氨气为工业固氮,正反应为放热反应,升高温度,平衡向逆反应方向移动,故答案为:人工固氮;逆反应;
(2)达到平衡时,正逆反应速率相等,各物质的浓度、含量不变,由于反应速率之比等于化学计量数之比,则bd不能说明达到平衡状态,
故答案为:a c;
(3)欲使NH3产率增大,应使平衡正向移动,可增大压强,分离出氨气,若容器容积为2L,开始加入的N2为0.1mol,20s后测得NH3的物质的量为0.08mol,则v(NH3)=$\frac{\frac{0.08mol}{2L}}{20s}$=0.002mol/(L•s),v(N2)=$\frac{1}{2}$v(NH3)=0.001 mol/(L•s),
故答案为:加压;分离氨;0.001;
(4)将集有氨气的试管倒置于水槽中,观察到试管内液面上升,溶液变为红色,原因是氨气易溶于水,试管内压强减小,液面上升;生成一水合氨,电离出OH-,溶液呈碱性,故溶液变为红色或NH3+H2O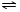 NH3•H2O
NH3•H2O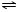 NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色,
NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色,
故答案为:氨气易溶于水,试管内压强减小,液面上升;生成一水合氨,电离出OH-,溶液呈碱性,故溶液变为红色或NH3+H2O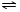 NH3•H2O
NH3•H2O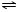 NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色;
NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色;
(5)(NH4)2SO4为强酸弱碱盐,水解呈酸性,发生NH4++H2O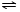 NH3•H2O+H+,可导致土壤酸化、板结,检验铵根离子,可取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+,
NH3•H2O+H+,可导致土壤酸化、板结,检验铵根离子,可取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+,
故答案为:NH4++H2O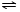 NH3•H2O+H+;取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+.
NH3•H2O+H+;取样,滴加过量浓NaOH溶液后加热,若产生的气体能使湿润的红色石蕊试纸变蓝,说明有NH4+.
点评 本题考查较为综合,涉及化学平衡的影响因素、化学反应速率的计算以及盐类的水解及应用等,为高考常见题型和高频考点,侧重考查学生的分析能力,熟悉温度、压强对平衡的影响即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铁粉与稀H2SO4反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na2CO3溶液与足量盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | Cu(OH)2固体与稀硫酸反应:OH-+H+═H2O | |
| D. | 铝片与NaOH溶液反应:Al+OH-+H2O═AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 二氧化硅可以和NaOH溶液及HF溶液反应 | 二氧化硅属于两性氧化物 |
| B | SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑ | 酸性:H2SiO3>H2CO3 |
| C | 向氯化铝溶液中滴加氢氧化钠溶液,观察到先产生白色沉淀后沉淀溶解 | 氢氧化铝可溶于强碱 |
| D | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝的熔点髙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、SO42-、Cl- | B. | Al3+、NO3-、Cl- | C. | K+、Fe3+、SO42- | D. | Na+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭还原氧化铜的硬质玻璃管(盐酸) | |
| B. | 碘升华实验的试管(酒精) | |
| C. | 长期存放氯化铁溶液的试剂瓶(稀硫酸) | |
| D. | 沾有油污的烧杯(纯碱溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
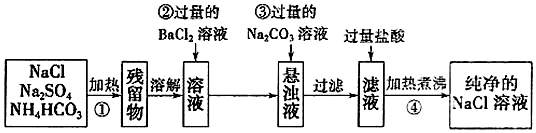
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]属于手性分子,因分子中存在手性碳原子 | |
| C. | 配合物中一定含有过渡金属原子或离子,因为过渡金属原子或离子存在空轨道 | |
| D. | 酸性H3PO4>HClO,是因为H3PO4分子非羟基氧原子数目比HClO多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com