
| A. | 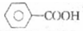 的同分异构体中能发生银镜反应的芳香族化合物有4种 的同分异构体中能发生银镜反应的芳香族化合物有4种 | |
| B. | 纤维素在人体中水解的最终产物是葡萄糖 | |
| C. | 烷烃与聚乙烯结构中均有碳碳单键 | |
| D. | 0.1mol 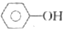 和 和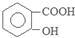 的混合物完全燃烧消耗O215.68L 的混合物完全燃烧消耗O215.68L |
分析 A、同分异构体中能发生银镜反应的芳香族化合物,官能团可以是一个醛基一个羟基,位置是邻、间、对3种;官能团可以是一个醛基一个醚键;
B、人体内没有水解纤维素的纤维素酶;
C、甲烷中只有1个碳原子,不存在碳碳单键;
D、根据1个  分子和1个
分子和1个 分子与氧气反应,都消耗7个氧气分子;
分子与氧气反应,都消耗7个氧气分子;
解答 解:A、同分异构体中能发生银镜反应的芳香族化合物,官能团可以是一个醛基一个羟基,位置是邻、间、对3种;官能团可以是一个醛基一个醚键,共有4种结构,故A正确;
B、人体内没有水解纤维素的纤维素酶,纤维素在人体中不水解,故B错误;
C、并不是所有烷烃分子中都含有碳碳键,如甲烷分子中只有1个C原子,不存在碳碳单键,故C错误;
D、1个  分子和1个
分子和1个 分子与氧气反应,都消耗7个氧气分子,所以0.1mol
分子与氧气反应,都消耗7个氧气分子,所以0.1mol  和
和 的混合物完全燃烧消耗0.7mol O2,即在标况下15.68L,故D错误;
的混合物完全燃烧消耗0.7mol O2,即在标况下15.68L,故D错误;
故选A.
点评 本题主要考查了有机物的结构与性质,燃烧规律,难度不大,注意纤维素在人体中不水解.


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(C)<r(D)<r(B) | |
| B. | 元素A与B只能形成一种化合物 | |
| C. | A的简单气态氢化物的热稳定性比C的强 | |
| D. | C的最高价氧化物的水化物的酸性比D的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2(aq)与Ca(OH)2(aq) | B. | Ca(HCO3)2(aq)与NaOH(aq) | ||
| C. | NaHCO3 (aq)与Ca(OH)2(aq) | D. | Mg(HCO3)2(aq)与NaOH (aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10Fe2++8I-+4Br-+11Cl2→10Fe3++4I2+2Br2+22Cl- | |
| B. | 2Fe2++2I-+2Cl2→2Fe3++I2+4Cl- | |
| C. | 6Fe2++4I-+5Cl2→6Fe3++2I2+10Cl- | |
| D. | 6Fe2++2I-+6Br-+7Cl2→6Fe3++I2+3Br2+14Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
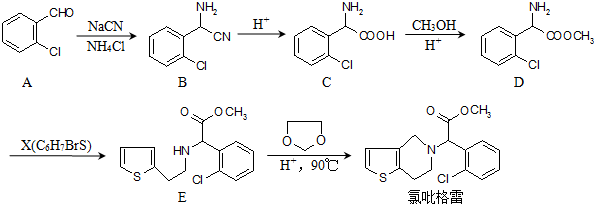
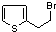 .
. .
.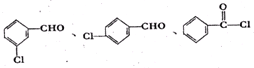 .
.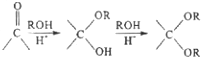
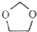 的合成路线图(无机试剂任选)
的合成路线图(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol对苯二甲酸中含有双键的数目为0.2NA | |
| B. | 常温下,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| C. | Fe在少量Cl2中燃烧生成0.5 mol产物,转移的电子数为NA | |
| D. | 标准状况下,2.24L H2S全部溶于水所得溶液中HS-和S2-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
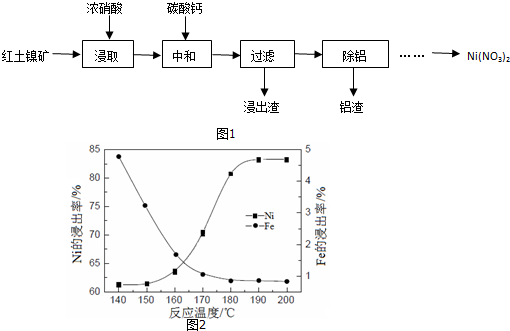
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 剩余的5.44g金属为铁 | B. | 剩余5.44g金属为铜 | ||
| C. | 共生成NO气体 0.03mol | D. | 8.08g金属中铁的质量分数为20.8% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com