
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g)+3Y2(g) 2XY3(g) △H=-92.6kJ·mol-1
2XY3(g) △H=-92.6kJ·mol-1
起始时各物质物质的量如下表所示:
容器 编号 | 起始时各物质物质的量/mol | ||
X2 | Y2 | XY3 | |
① | 1 | 3 | 0 |
② | 0.6 | 1.8 | 0.8 |
达到平衡后,①容器中XY3的物质的量为0.5mol。下列叙述正确的是
A.容器①、②中反应的平衡常数不相等
B.达平衡时,容器②中XY3的物质的量浓度为2mol·L—1
C.容器①中反应达到平衡时放出的热量为23.15 kJ
D.容器②中反应达到平衡时放出热量
BC
【解析】
试题分析:A、平衡常数只与温度有关,温度不变,对同一反应平衡常数不变,所以容器①、②中反应的平衡常数相等,错误;B、依据化学平衡三段式列式计算,实验①中;
X2(g)+3Y2(g)?2XY3(g)
起始量(mol) 1 3 0
变化量(mol) 0.25 0.75 0.5
平衡量(mol) 0.75 2.25 0.5
②起始量 0.6 1.8 0.8
转化后 1 3 0
所以②与①为完全等效平衡,所以,平衡时②容器中X2、Y2和XY3的物质的量也分别为0.75mol、2.25mol和0.5mol,达平衡时,容器②中 XY3的物质的量浓度=0.5mol÷0.25L=2mol?L-1,正确;C、实验①中
X2(g)+3Y2(g)?2XY3(g)
起始量(mol) 1 3 0
变化量(mol) 0.25 0.75 0.5
平衡量(mol) 0.75 2.25 0.5
依据焓变计算容器①中反应达到平衡时放出的热量=0.25mol×92.6KJ/mol=23.15kJ,正确;D、上述计算可知平衡时①容器中X2、Y2和XY3的物质的量分别为0.75mol、2.25mol和0.5mol,②与①为完全等效平衡,所以,平衡时②容器中X2、Y2和XY3的物质的量也分别为0.75mol、2.25mol和0.5mol,可知②的反应向逆反应方向进行,反应过程需要吸收热,错误。
考点:本题考查化学平衡移动、等效平衡、反应热。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
关于吸热反应的说法,正确的是
A、凡需加热的反应一定是吸热反应
B、只有分解反应才是吸热反应
C、使用催化剂的反应是吸热反应
D、酸碱中和反应的逆反应是吸热反应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
下列化学反应属于吸热反应的是
A.碘的升华 B.生石灰溶于水
C.镁与稀盐酸反应 D.熟石灰与NH4Cl晶体混合制氨
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
下列与含氯化合物有关的说法正确的是
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:填空题
(12 分) X、Y、Z、W、Q五种元素其核电荷数依次增大。X原子只有1个s电子,Y、Z、W属于同周期,Y原子L层中s电子和p电子数目相同,Z原子p轨道为半充满,W原子第一电离能比Z原子的小,Q原子内层均饱和,N层上只有两个电子。
(1)Q2+离子的核外电子排布式为 。
(2)XYZ分子中Y原子轨道的杂化类型为 ,
1molXYZ分子中含有σ键的数目为 。
(3)写出YZW-离子的两种等电子体的化学式: 。
(4)QW的熔点比Q的硫化物的熔点高,其原因是
。
(5)Q晶体属于六方堆积,其晶胞结构见下图,则P点原子
被 个晶胞所共用。
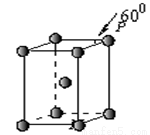
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的过程正确的有:
①蛋白质的变性 ②蛋白质的盐析 ③胶体的聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
A.①②③④ B.①③④⑥ C.②③④⑤ D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42-
C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO
D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.氯化铝溶液中加入过量的氨水:Al3++4 NH3·H2O=AlO2-+4 NH4+
B.稀硝酸中加入过量铁粉:Fe+4H++NO3- = Fe3++NO↑+2H2O
C.二氧化锰与浓盐酸混合加热:MnO2+4H++2Cl- △ Mn2++ Cl2↑+2H2O
D.石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH= +41.2 kJ/mol;
CO(g)+H2O(g),ΔH= +41.2 kJ/mol;
反应②: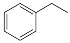 (g)
(g)
 (g)+H2(g),ΔH= +117.6 kJ/mol。
(g)+H2(g),ΔH= +117.6 kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
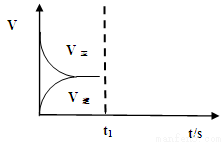
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请
画出t1之后的正逆反应曲线,并作出标注。
(3)已知某温度下,Ag2SO4饱和溶液中c(Ag+)=0.04 mol/L,则该温度
下Ksp(Ag2SO4)= 。(保留两位有效数字)
(4)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH-=FeO42-+3H2↑,电解质溶液选用NaOH溶液。该电解池阳极材料是 (写化学式);阳极的电极反应式为__ _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com