
| A. | 分子中C、H、O的个数比为1:2:3 | B. | 分子中C、H的个数比为1:2 | ||
| C. | 该有机物的相对分子质量为14 | D. | 该分子中肯定不含氧 |
分析 生成的水和二氧化碳的物质的量比为1:1,所以可以据此可以求算出其中碳原子和氢原子的个数比为2:1,但是不能判断其中氧原子与碳原子及氢原子的个数比,然后结合质量守恒定律即可完成判断.
解答 解:A、根据质量守恒定律可以判断在有机物中含有碳原子和氢原子,但是不能判断出该有机物中是否含有氧元素,所以也就无从求算其该有机物中碳氢氧三种原子的个数比,故A错误;
B、根据题意可以知道生成的水和二氧化碳的物质的量比为1:1,即生成的水和二氧化碳的分子个数相等,而一个水分子中含有2个氢原子,一个二氧化碳分子中含有一个碳原子,即该有机物中碳原子和氢原子的个数比为1:2,故B正确;
C、根据题意只能确定该有机物中碳原子和氢原子的个数比,不能判断出该有机物中是否含有氧元素,就不能确定有机物的分子式以及相对分子式量的大小,故C错误;
D、根据质量守恒定律可以判断在有机物中含有碳原子和氢原子,但是不能判断出该有机物中是否含有氧元素,故D错误;
故选:B.
点评 本题主要考查了学生的分析计算能力和对元素守恒以及质量守恒的运用,对氧元素的确定容易出错,是本题的盲点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)基态铬原子的价电子排布式为3d54s1.
(1)基态铬原子的价电子排布式为3d54s1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 | |
| B. | ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是三种不同核素,互称为同位素,都属于氢元素 | |
| C. | X、Y两种元素的简单离子具有相同的电子层结构,则核电荷数大的元素离子半径小 | |
| D. | 18O中质子数与中子数不相等,但其和为18 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A | ||
| B | C | D |
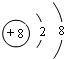
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 卤素原子半径逐浙减少 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
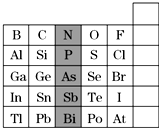 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分: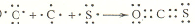 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p4 | B. | 1s22s22p63s23p3 | ||
| C. | 1s22s22p3 | D. | 1s22s22p63s23p64s2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com