
【题目】下列离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.碳酸钙与醋酸溶液反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
C.200mL2mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:
4Fe2+ + 6Br-+ 5Cl2 == 4Fe3+ + 3Br2 + 10Cl-
D.Na2S的水解:S2- + 2H2O ![]() H2S + 2OH-
H2S + 2OH-
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】如图为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述中不正确的是( )
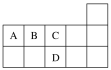
A.A、C两元素形成的化合物都为共价化合物
B.AD2的电子式为![]()
C.B2的结构式为N≡N
D.B、C形成的化合物BC中所含化学键为非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池构造如图所示。其电池反应方程式为:2H2+O2=2H2O
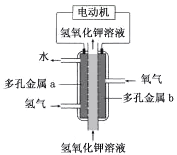
下列说法不正确的是
A. 多孔金属a作负极
B. 多孔金属b上,O2发生还原反应
C. 电池工作时,电解质溶液中OH- 移向a极
D. 正极的电极反应为:O2 +4e- +4H+ =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为将含有的FeCl3、FeCl2、CuCl2的废液中的Cu2+还原回收,某同学在含有ag铁粉的容器中加入废液,探究了加入废液体积与完全反应后体系中固体质量的关系,部分实验数据如下表所示。已知:废液中c(Cu2+)=0.7 mol·Lˉ1;废液体积大于0.5L,充分反应后才能检测出Cu2+。

下列说法不正确的是
A. 当铁粉与0.25L废液反应完全后,固体成分为Fe与Cu
B. 当铁粉与1L废液反应完全后,再加入废液时发生的离子反应为Fe +2Fe3+=3Fe2+
C. 废液中c(Fe3+)=0.2 mol·Lˉ1
D. 要将1L废液中的Cu2+全部还原,则至少需要铁粉44.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用![]() 与浓盐酸反应制备
与浓盐酸反应制备![]() 。
。
(1)制备反应会因盐酸浓度下降面停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量![]() 溶液反应,称量生成的
溶液反应,称量生成的![]() 质量。
质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与己知量![]() (过量)反应,称量剩余的
(过量)反应,称量剩余的![]() 质量。
质量。
丁方案:与足量![]() 反应,测量生成的
反应,测量生成的![]() 体积。
体积。
继而进行下列判断和实验:
①判定甲方案不可行。现由是_________。
②进行乙方案实验;准确量取残余清液稀释一定倍数后作为试样。
a.量取试样![]() ,用
,用![]() 标准溶液滴定,选择的指示剂是____,消耗
标准溶液滴定,选择的指示剂是____,消耗![]() ,该次滴定测得试样中盐酸浓度为_______
,该次滴定测得试样中盐酸浓度为_______![]()
b._________,获得实验结果。
③判断两方案的实验结果________(填“偏大”、“偏小”或“准确”).
[已知:![]() 、
、![]() ]
]
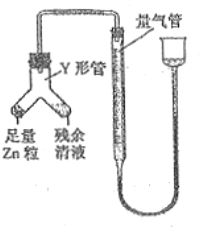
④进行丁方案实验:装置如图所示(夹持器具已略去)。
a.使Y形管中的残余清液与锌粒反应的正确操作是将_______转移到____中。
b.反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是__________(排除仪器和实验操作的影响因素),至体积不变时,量气管的左侧液面高于右侧液面,此时读数测得的体积__________(填“偏大”、“偏小”或“准确”)
(2)若没有酒精灯,也可以采用![]() 与浓盐酸反应制取适量氯气的如下简易装置。
与浓盐酸反应制取适量氯气的如下简易装置。
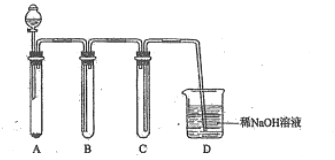
装置B、C、D的作用分别是:
B___________C______________D______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 molL﹣1的KI溶液:Na+、Ag+、NO3﹣、SO42﹣
B. 使甲基橙变红色的溶液:NH4+、Cu2+、ClO﹣、Cl﹣
C. c(OH﹣)=0.1mol/L的溶液:Na+、K+、CO32﹣、ClO﹣
D. 0.1 molL﹣1的KMnO4溶液:Na+、K+、Cl﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是____________(填标号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔点/°C | 1570 | 2800 | 23.8 | 75.5 |
解释表中氧化物之间熔点差异的原因__________。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=__________pm,Mg原子之间最短距离y=__________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是__________g·cm3(列出计算表达式)。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①盐卤(含MgCl2)![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() 无水MgCl2
无水MgCl2
②铝土矿![]() AlO2-
AlO2-![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3
③NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
④NaCl溶液![]() Cl2
Cl2![]() 无水FeCl2
无水FeCl2
⑤S![]() SO3
SO3![]() H2SO4
H2SO4
⑥SiO2![]() Na2SiO3溶液
Na2SiO3溶液![]() H2SiO3
H2SiO3
A. ③⑥B. ③⑤⑥C. ①④⑤D. ①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
A. 制取并收集少量乙炔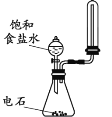
B. 制取并检验乙烯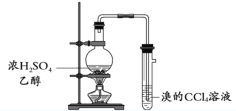
C. 检验溴乙烷与NaOH乙醇溶液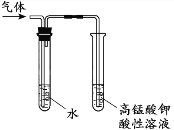
D. 制取并提纯乙酸乙酯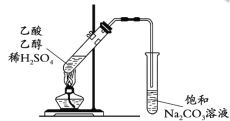
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com