
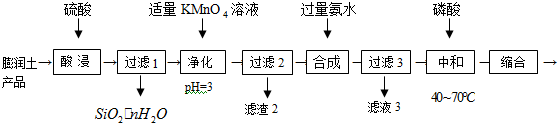

分析 膨润土(主要成分:Al2O3•4SiO2•3H2O;含少量杂质:FeO、Fe2O3、Na2O等)为原料制备三聚磷酸铝[AlH2P3O10•2H2O],加稀硫酸,Al2O3、FeO、Fe2O3、Na2O转化为离子,SiO2不溶于硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+,加高锰酸钾溶液,Fe2+被氧化为Fe3+,同时生成的锰离子可再被高锰酸钾氧化成二氧化锰,调节PH值,得氢氧化铁沉淀和二氧化锰沉淀,所以滤渣2为Fe(OH)3、MnO2,滤液中主要含有硫酸铝及少量硫酸钠杂质,再加入氨水得氢氧化铝沉淀,过滤,滤液3中含有硫酸钠和硫酸铵还有氨水,氢氧化铝中加入磷酸,缩合可得三聚磷酸铝,据此答题.
解答 解:膨润土(主要成分:Al2O3•4SiO2•3H2O;含少量杂质:FeO、Fe2O3、Na2O等)为原料制备三聚磷酸铝[AlH2P3O10•2H2O],加稀硫酸,Al2O3、FeO、Fe2O3、Na2O转化为离子,SiO2不溶于硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+,加高锰酸钾溶液,Fe2+被氧化为Fe3+,同时生成的锰离子可再被高锰酸钾氧化成二氧化锰,调节PH值,得氢氧化铁沉淀和二氧化锰沉淀,所以滤渣2为Fe(OH)3、MnO2,滤液中主要含有硫酸铝及少量硫酸钠杂质,再加入氨水得氢氧化铝沉淀,过滤,滤液3中含有硫酸钠和硫酸铵还有氨水,氢氧化铝中加入磷酸,缩合可得三聚磷酸铝,
(1)Al2O3•4SiO2•3H2O与硫酸反应的化学方程式为Al2O3•4SiO2•3H2O+3H2SO4+(4n-6)H2O=4SiO2•nH2O+Al2(SO4)3,
故答案为:Al2O3•4SiO2•3H2O+3H2SO4+(4n-6)H2O=4SiO2•nH2O+Al2(SO4)3;
(2)根据上面的分析可知,Fe2+被氧化为Fe3+的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,滤渣2中两种沉淀为Fe(OH)3和MnO2,故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;MnO2;
(3)滤液3中含有硫酸钠和硫酸铵还有氨水,由于氨水的电离程度大于铵根离子的水解程度,所以当溶液中c(NH4+)=c(NH3•H2O)时该溶液显碱性,故答案为:碱;
(4)根据图可知,当原料配比n(H3PO4)/n[Al(OH)3]=3.0时,{n(P2O5)/n[Al2O3]}的比值最大,所以“中和”时反应发生反应的化学方程式为3H3PO4)+Al(OH)3=Al(H2PO4)3+3H2O,故答案为:3H3PO4)+Al(OH)3=Al(H2PO4)3+3H2O.
点评 本题以氧化铝提取工艺流程为载体,考查元素化合物性质及相互转化、氧化还原、离子方程式、实验基本操作等知识点,注意把握制备原理,把握物质的性质以及相关反应方程式的书写,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
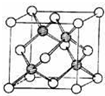 氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题:
氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题: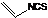 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纯净水 | B. | 0.1mol•L-1HCl | ||
| C. | 1.0mol•L-1CH3COOH | D. | 0.5mol•L-1H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 2-甲基-2,4-己二烯
2-甲基-2,4-己二烯
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 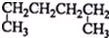 1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 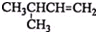 3-甲基丁烯 3-甲基丁烯 | ||
| C. | 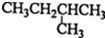 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和NaOH完全反应的中和热为-114.6kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)═2CO2(g);△H=-283.0kJ/mol | |
| C. | 一个化学反应的热效应,只与反应的始态与终态有关,与反应的过程无关 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
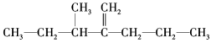 的系统命名为:3-甲基-2-丙基-1-戊烯
的系统命名为:3-甲基-2-丙基-1-戊烯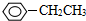 ③?H COOH、④CH3COOC2H5.
③?H COOH、④CH3COOC2H5.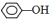 ;②CH2=CH2;③CH≡CH;④
;②CH2=CH2;③CH≡CH;④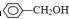 ;⑤
;⑤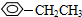 ;
;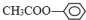 ;⑦CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是⑥⑦. (填写上述物质的序号)
;⑦CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是⑥⑦. (填写上述物质的序号)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com