
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法正确的是
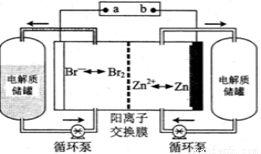
A.充电时电极b连接电源的正极
B.放电时正极的电极反应式为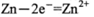
C.阳离子交换膜可阻止Br2与Zn直接发生反应
D.充电时左侧电解质储罐中的离子总浓度增大
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源:2014-2015广东省佛山市高二下学期第一次月考理化学试卷(解析版) 题型:填空题
(12分)下图中的实验装置可以用于实验室制取乙炔。请填空:
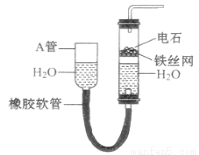
(1)图中A管的作用是 ,制取乙炔的化学反应方程式为 。
(2)乙炔通入酸性KMnO4溶液中,发生 反应,可以观察到的现象为 ,
若通入溴水中,发生 反应,反应方程式为 。
(3)乙炔燃烧的化学方程式为 ,燃烧时的现象为 ,
为了安全,点燃乙炔前应该先 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河西区高三下学期总复习质量调查一理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.KI溶液中滴加稀硫酸:4H+ +4I-+O2=2I2+2H2O
B.过量SO2通入氨水中:2NH3·H2O+SO2=2NH4++SO32-+H2O
C.NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+= Al(OH)3↓
D.氨水滴入AgNO3溶液中至沉淀完全:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省资阳市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
某温度T1时,向容积为2 L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g)  2HI(g)反应过程中测定的部分数据见下表(表中t2>t1):
2HI(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(H2)/mol | n(I2)/mol |
0 | 0.9 | 0.3 |
t1 | 0.8 | |
t2 | 0.2 |
下列说法正确的是
A.反应在t1 min内的平均速率为:v(H2)=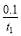 mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变
C.保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时n(HI)=0.2 mol
D.升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:填空题
(12分)(1)已知下列反应的热化学方程式为:
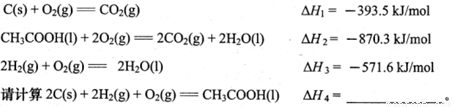
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
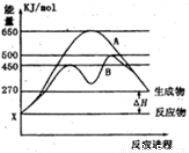
①据图判断该反应是_______(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,降低温度,反应物的转化率_______(填“增大”、“减小”或“不变”);
②其中B历程农明此反应采用的条件为__________(选填序号)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
(3)一定温度下,在3L容积可变的密闭容器中发生反应H2(g)+CO2(g) 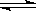 H2O (g)+CO(S),已知c(CO)与反应时间t变化曲线I如图所示,
H2O (g)+CO(S),已知c(CO)与反应时间t变化曲线I如图所示,
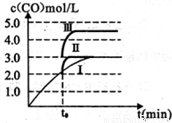
若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。 当曲线I变为曲线II时,改变的条件是_______________。当曲线I变为曲线III时,改变的条件是________.
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将0.2 mol/L的乙酸与0.1 mol/LNaOH溶液等体积混合后溶液显酸性,则混合溶液中离子浓度由大到小的顺序为_________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.苯甲醛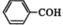 B.Mg2+的结构示意图:
B.Mg2+的结构示意图:
C.CO2的电子式 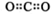 D.核内有8个中子的碳原子:
D.核内有8个中子的碳原子: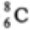
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三第二次联考理综化学试卷(解析版) 题型:填空题
[化学——选修3物质结构与性质](15分)现有aA、bB、cC、dD、eE、gG六种短周期非金属元素,a+b=c,a+c=d,a+d=e,d+e=g,C、E、G的单质均有在中学常见的两种或多种同素异形体,请回答下列问题:
Ⅰ.(1)C、D、E元素的第一电离能由大到小的关系为__________。(用元素符号表示)
(2)请比较C2A4、D2A4、G2A4三种化合物的沸点由高到低的顺序为______________。(用化学式表示)
(3)有某种分子式为C4D4E8的物质(该物质中同种原子的化学环境完全相同,不含碳碳双键)是一种威力极强的炸药,则可推知其结构简式为____________。
Ⅱ.BG是一种耐磨材料,其结构与金刚石相似,下图为其晶体结构单元,它可由B的三溴化物和G的三溴化物于高温下在氢气的氛围中合成。
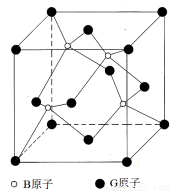
(1)指出B的三溴化物中B的杂化方式为________G的三溴化物分子的结构为_______型。
(2)写出合成BG的化学反应方程式为____________________。
(3)已知晶体中B与G原子的最近距离为a pm,则该晶体的密度的表达式为____g/cm3。(不需化简)
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市奉贤区高三第二学期调研测试化学试卷(解析版) 题型:填空题
(本题共12分)目前,碳族元素按原子序数增大,依次为:碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)。请回答:
23.锗原子的最外层电子排布式: ,锡原子的最外层电子云有 种伸展方向; 单质锗具有__________(填字母)。
a.只有金属性
b.只有非金属性
c.既有金属性,又有非金属性
24.某同学根据反应:SiO2 + 2C Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由: 。
Si + 2CO↑,得出结论:碳的非金属性强于硅的反应。请对此给予评价并说明理由: 。
25.常温下,在400mL稀氢氟酸中,投入一颗石英玻璃,2.5min后,溶液质量减少了11.22g。此时SiF4为气体,则这段时间内用HF表示该反应的平均化学反应速率为 。
高温下,在容积固定的密闭容器中,用足量焦炭与一定量二氧化碳发生可逆的吸热反应生成了CO。回答26-27题:
26.下列选项中,一定符合反应达到化学平衡时情况的选项是 。
a.压缩体积达到新平衡时,CO的浓度增大的倍数比CO2的浓度增大的倍数更大
b.速率关系:2v(CO2)= v(CO)
c.转移电子数随温度升高而增多
d.气体密度随着焦炭的增加而增大
27.达到化学平衡之后,保持其他条件不变,移走少量CO,达到新的平衡时,下列选项中,增大的是 (填选项编号)。
A.CO2和CO浓度比 b.混合气体的密度
c.转化率 d.CO的体积分数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com