
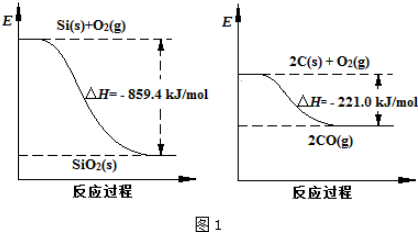
| A. | 乙醇和乙酸制乙酸乙酯;苯的硝化反应 | |
| B. | 乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷 | |
| C. | 葡萄糖与新制氢氧化铜共热;蔗糖与稀硫酸共热 | |
| D. | 乙醇和氧气制乙醛;苯和氢气制环己烷 |
分析 根据物质的性质及反应来分析选项中的反应的类型,掌握常见的有机反应类型有取代、加成、氧化等.
有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应;
有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
反应过程中有电子转移的化学反应是氧化还原反应,在有机反应中加H去O属于还原反应,反之加O去H属于氧化反应;
有机化合物在有β氢的条件下,从一个分子中脱去一个或几个小分子(如水、卤化氢等分子),而生成不饱和(碳碳双键或三键或苯环状)化合物的反应,叫做消去反应.
A.乙醇和乙酸制乙酸乙酯,乙酸中-OH被取代,苯的硝化反应中苯环上的H被硝基取代;
B.乙烷分子中的氢原子被氯原子取代,乙烯与氯化氢反应制氯乙烷属于乙烯的加成反应;
C.葡萄糖与新制氢氧化铜共热属于醛基的氧化;蔗糖与稀硫酸共热属于蔗糖的水解属于取代反应;
D.乙醇和氧气制乙醛属于氧化反应;苯和氢气制环己烷属于加成反应;
解答 解:A.乙醇和乙酸制乙酸乙酯,乙酸中-OH被取代,苯的硝化反应中苯环上的H被硝基取代,均属于取代反应,类型相同,故A正确;
B.乙烷和氯气制氯乙烷,属于取代反应;乙烯与氯化氢反应制氯乙烷,属于加成反应,二者反应类型不同,故B错误;
C.葡萄糖和新制氢氧化铜共热发生的反应是氧化还原反应,蔗糖和稀硫酸共热发生水解反应,所以反应类型不同,故C错误;
D.乙醇和氧气制乙醛属于氧化反应;苯和氢气制环己烷,属于加成反应或还原反应,二者反应类型不同,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物中的官能团及官能团与性质的关系为解答的关键,侧重性质及有机反应类型的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
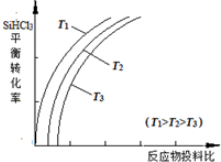
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于100 mL | B. | 200 mL | C. | 400 mL | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,元素g的简单离子的结构示意图为
,元素g的简单离子的结构示意图为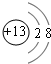 ,二者的离子半径大小顺序为F->Al3+.
,二者的离子半径大小顺序为F->Al3+.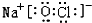 ,该化合物中所含的化学键类型为离子键、共价键.
,该化合物中所含的化学键类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价为+6 | |
| B. | 离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的沸点:Y>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
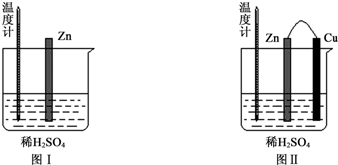
| 实验现象 | 解释原因 |
| Cu片上产生了大量气泡 | Zn、Cu构成原电池,H+在Cu片上得电子产生氢气 |
| 温度计指示的温度无明显变化 | 反应中的化学能主要转化成了电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com