
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2II
CO(g)+H2O(g)ΔH2II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=;反应II的ΔH2=kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是。
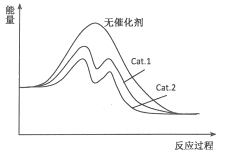
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是。
【答案】(1)![]() +41.2
+41.2
(2)CD
(3)表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。
(4)
(5)阴 CO2+6H++6e==CH3OH+H2O
【解析】
试题分析:(1)根据平衡常数的公式,生成物的浓度幂之积与反应物浓度的幂之积的比值,书写平衡常数为![]() 。已知热化学方程式:a:CO(g)+
。已知热化学方程式:a:CO(g)+![]() O2(g)=CO2(g)△H= -283.0kJ·mol-1 b:H2(g)+
O2(g)=CO2(g)△H= -283.0kJ·mol-1 b:H2(g)+![]() O2(g)=H2O (l)△H=-285.8kJ·mol-1 c: H2O(l)
O2(g)=H2O (l)△H=-285.8kJ·mol-1 c: H2O(l)![]() H2O(g) ΔH3=44.0kJ·mol-1根据盖斯定律分析,b-a+c即可得热化学方程式为:CO2(g)+ H2(g)
H2O(g) ΔH3=44.0kJ·mol-1根据盖斯定律分析,b-a+c即可得热化学方程式为:CO2(g)+ H2(g)![]() CO(g)+H2O(g)ΔH2=-285.8+283.0+44=+41.2 kJ·mol-1。(2)反应Ⅰ中A、使用催化剂,平衡不移动,不能提高转化率,错误;B、使用催化剂,平衡不移动,不能提高转化率,错误;C、降低反应温度,平衡正向移动,提高二氧化碳的转化率,正确;D、投料比不变,增加反应的浓度,平衡正向移动,提高二氧化碳的转化率,正确;E、增大二氧化碳和氢气的初始投料比,能提高氢气的转化率,二氧化碳的会降低,故错误。故选CD。(3)从表格数据分析,在相同的温度下,不同的催化剂,相同的反应时间内,其二氧化碳的转化率也不同,说明不同的催化剂的催化能力不同;相同催化剂不同的温度,二氧化碳的转化率不同,且温度高的转化率大,因为正反应为放热反应,说明表中数据是未到平衡数据。所以答案为:表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。
CO(g)+H2O(g)ΔH2=-285.8+283.0+44=+41.2 kJ·mol-1。(2)反应Ⅰ中A、使用催化剂,平衡不移动,不能提高转化率,错误;B、使用催化剂,平衡不移动,不能提高转化率,错误;C、降低反应温度,平衡正向移动,提高二氧化碳的转化率,正确;D、投料比不变,增加反应的浓度,平衡正向移动,提高二氧化碳的转化率,正确;E、增大二氧化碳和氢气的初始投料比,能提高氢气的转化率,二氧化碳的会降低,故错误。故选CD。(3)从表格数据分析,在相同的温度下,不同的催化剂,相同的反应时间内,其二氧化碳的转化率也不同,说明不同的催化剂的催化能力不同;相同催化剂不同的温度,二氧化碳的转化率不同,且温度高的转化率大,因为正反应为放热反应,说明表中数据是未到平衡数据。所以答案为:表中数据表明此时反应未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响。
(4)从表中数据分析,在催化剂Cat.2的作用下,甲醇的选择性更大,说明催化剂Cat.2对反应Ⅰ的催化效果更好,催化剂能降低反应的活化能,说明使用催化剂Cat.2的反应过程中活化能更低,故图为:
(5)二氧化碳变甲醇,碳元素的化合价降低,得到电子,说明其在阴极反应,其电极反应为: CO2+6H++6e-==CH3OH+H2O


科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为探究金属与浓硫酸反应,进行了如下实验。
Ⅰ.探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:实验装置如图所示。(固定装置已略去)
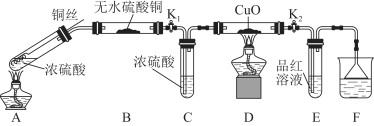
(1)A中反应的化学方程式为 ;
A装置铜丝如图设计的原因是 。
(2)C中浓硫酸的作用是 。
(3)F烧杯中的溶液通常是 。
(4)实验过程中,能证明浓硫酸与铜反应后产物中硫元素的氧化性强于氢元素的现象是 。
(5)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含碘元素,从海带中提取碘有如下步骤:①加入足量双氧水(含稀硫酸);②将
海带焙烧成灰后加水搅拌;③加CCl4振荡;④用分液漏斗分液; ⑤过滤。合理的操作顺序是( )
A. ①②③④⑤ B. ①③⑤②④ C. ②⑤①③④ D. ②①③⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了预防碘缺乏症,国家规定每千克食盐中应含有40~50 mg碘酸钾。碘酸钾晶体具有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂反应生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等更强的氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如图所示。

(1)碘在周期表中的位置为__________________;
(2)碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,请配平该反应的化学方程式:____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2↑;
(3)混合反应后,用稀酸酸化的作用是___________________________,在稀盐酸和稀硝酸中不能选用的酸是_________,理由是__________________________________;
(4)试剂X的化学式为__________,写出用试剂X调pH的化学方程式__________________;
(5)如果省略“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应混合物的pH,对生产碘酸钾有什么影响?________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2是怎么样产生的? (用一句话说明)。
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是: 。
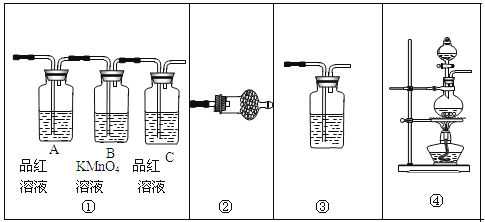
(3)实验时若观察到:①中从左到右A瓶中品红溶液褪色,B瓶中高锰酸钾溶液颜色逐渐变浅,C瓶中品红溶液不褪色,则A瓶的作用是______,B瓶的作用是______,C瓶的作用是______。
(4)装置②中所加的试剂名称是______,它可以验证的气体是______,简述确定装置②在整套装置中的位置的理由是___ ___。
(5)装置③中所盛溶液的名称是______,它可以用来验证的气体是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质按照强电解质、弱电解质、非电解质、能导电的顺序排列的选项是
A. 氯化氢 氨气 甲烷 铜
B. H2SO4 HF 乙醇 氯化钠溶液
C. 氢氧化钡 氢氧化钙 二氧化碳 氨水
D. 氯化氢 食醋 葡萄糖 银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将22.4 L HCl溶于水配制1 L溶液,其溶质的物质的量浓度为1.0 mol/L
B.1 mol/L的Na2CO3溶液中含有2 mol Na+
C.500 mL 0.5 mol/L的(NH4)2SO4溶液中含有NH4+个数为0.5NA(NA为阿伏加德罗常数)
D.Na+浓度为0.2 mol/L的Na2SO4溶液中SO42-浓度为0.1 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com