
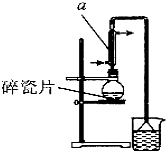
 ������±�ᷴӦ���Ʊ�±��������Ҫ������ʵ�����Ʊ� 1-�嶡��ķ�Ӧ��ʵ��װ�����£�
������±�ᷴӦ���Ʊ�±��������Ҫ������ʵ�����Ʊ� 1-�嶡��ķ�Ӧ��ʵ��װ�����£�| �۵�/�� | �е�/�� | �ܶ�/g•cm-3 | |
| ������ | -89.53 | 117.25 | 0.81 |
| 1-�嶡�� | -112.4 | 101.6 | 1.28 |
���� ��1���������ṹ��֪AΪֱ�������ܣ���Ӧ����ʱ���¶Ȳ��˳���100�棬��ȡˮԡ���ȣ����Ƭ���Է�ֹ����ʱ���У��廯�⼫������ˮ��������
��2������Ũ����Ĵ�������ˮ����ϩ���ѣ�Br-��Ũ��������ΪBr2�ȣ�Ũ�������ջ���ȣ�����ʹHBr�ӷ���
��3����ȡ������õ�1-�嶡�飬����Ҫ���������ƾ��Ƽ�������ƿ��
��4����������¶ȸ���101.6�棬����117.25�棬���¶���ˮ���γ�ˮ������
��5��1-�嶡�鲻����ˮ���ܶȱ�ˮ��
��6����������������1-�嶡������۲���������=$\frac{ʵ�ʲ���}{���۲���}$��100%��
��� �⣺��1���������ṹ��֪AΪֱ�������ܣ���Ӧ����ʱ���¶Ȳ��˳���100�棬�Ϻõļ��ȷ����Dz�ȡˮԡ���ȣ��Ϻõļ��ȷ��������Ƭ���Է�ֹ����ʱ���У��廯�⼫������ˮ��װ���е���©���������ǣ�
�ʴ�Ϊ��ֱ�������ܣ�ˮԡ���ȣ���ֹ���У���ֹ�廯�⼫������ˮ��������
��2��a��Ũ�����1-������Ӧ������ȥ��Ӧ����ϩ�������Ӽ���ˮ��Ӧ�����ѣ�ϡ�ͺ��ܷ������Ʒ�Ӧ���ٸ�����ϩ���ѵ����ɣ���a��ȷ��
b��Ũ�������ǿ�������ܽ�����������Ϊ�嵥�ʣ�ϡ��Ũ������ܼ���Br2�����ɣ���b��ȷ��
c����Ӧ��Ҫ�廯���1-������Ӧ��Ũ�����ܽ���Һ�¶����ߣ�ʹ�廯��ӷ���ϡ�ͺ����HBr�Ļӷ�����c��ȷ��
d��ˮ�Dz��ﲻ�Ƿ�Ӧ�Ĵ�������d����
��ѡ��abc��
�ʴ�Ϊ��abc��
��3����ȡ������õ�1-�嶡�飬����װ�ó����õ������ܡ��¶ȼơ�ţ�ǹܡ���ƿ������Ҫ�IJ��������Ǿƾ��ơ�������ƿ��
�ʴ�Ϊ���ƾ��ơ�������ƿ��
��4����������¶ȸ���101.6�棬����117.25�棬���¶���ˮ���γ�ˮ���������ܺ��е�������Ҫ��ˮ��
�ʴ�Ϊ��ˮ��
��5��1-�嶡�鲻������ˮ�����ܶȴ���ˮ�����Խ�1-�嶡��ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã��������²㣬
�ʴ�Ϊ���²㣻
��6��7.4g�������淴Ӧ����1-�嶡������Ϊm����
C4H9-OH+HBr$\stackrel{��}{��}$C4H9-Br+H2O
74 137
7.4g 13.7
�����Ƶ�1һ�嶡��9.6g��
��1-�嶡��IJ���=$\frac{9.6g}{13.7g}$��100%��70%��
�ʴ�Ϊ��70%��
���� ���⿼���л����Ʊ�ʵ�飬�漰��װ��������ķ������ۡ�ʵ�������������ԭ���ķ������ۡ����ʼ���ȣ�ע�����Ŀ��Ϣ�����ݵ�Ӧ�ã��ϺõĿ�����ѧ���������⡢���������������Ѷ��еȣ�


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CuCl2��Һ | B�� | AlCl3��Һ | C�� | MgCl2��Һ | D�� | BaCl2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�80 g SO3��ռ�����ԼΪ22.4 L | |
| B�� | ���³�ѹ�£�1.6 gO2��O3�����������������Ϊ0.8NA | |
| C�� | 0.1 mol����-CH3������������ΪNA | |
| D�� | ������״̬�£�1 mol NaHSO4��ȫ���������������ĿΪ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
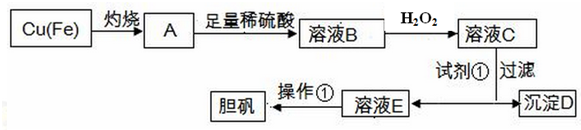
| ���� | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 |
| ��ʼ������pH | 1.8 | 6.3 | 5.2 |
| ��ȫ������pH | 3.0 | 8.3 | 6.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
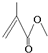 �����ķ���ʽΪC5H8O2�����ڵĹ�������̼̼˫�����������������ܷ����ķ�Ӧ�����мӳɷ�Ӧ��������Ӧ��ˮ�ⷴӦ��
�����ķ���ʽΪC5H8O2�����ڵĹ�������̼̼˫�����������������ܷ����ķ�Ӧ�����мӳɷ�Ӧ��������Ӧ��ˮ�ⷴӦ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
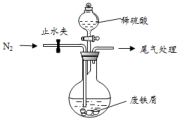 ҽ�����̷���FeSO4•7H2O��������ȱ����ƶѪ����Чҩ��ij��ѧ��ȤС����̷����������µ�̽����
ҽ�����̷���FeSO4•7H2O��������ȱ����ƶѪ����Чҩ��ij��ѧ��ȤС����̷����������µ�̽�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
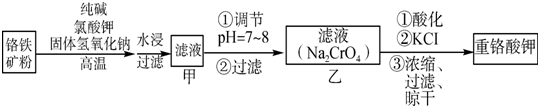
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
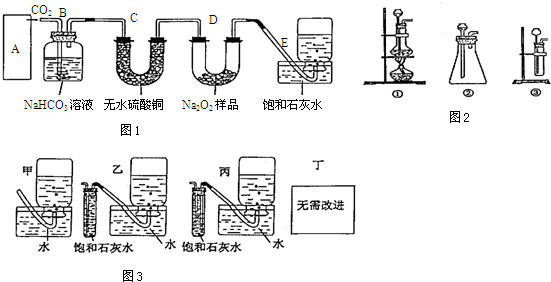
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com