
| 实验步骤 | 实验结论 |
| ①氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
分析 (1)小型实验可以在试管中进行反应,滴加液体用胶头滴管;
(2)四氯化碳不参加反应,与水分层,卤素单质不易溶于水,易溶于四氯化碳,所以CCl4可作为萃取剂,从水中分离出卤素单质;
(3)非金属单质的氧化性强弱可以通过单质间的置换反应来比较,氧化性Cl2>Br2>I2.
解答 解:(1)该实验可在试管中进行反应,还需要胶头滴管滴加液体;四氯化碳不参加反应,与水不互溶,卤素单质不易溶于水,易溶于四氯化碳,所以其作用为萃取剂,使生成的Br2、I2溶于其中,便于观察现象,
故答案为:试管、胶头滴管;萃取剂;
(2)Cl2可以与Br-发生氧化还原反应,Br-被氧化为为Br2,Cl2被还原为Cl-;Cl2也可以与I-发生氧化还原反应,I-被氧化为I2,Cl2被还原为Cl-.
故答案为:Cl2+2Br-=Br2+2Cl-;Cl2+2I-=I2+2Cl-;
(3)该同学设计的实验中,第②歩可以证明Cl2的氧化性强于Br2,第③歩可证明Cl2的氧化性强于I2.这不足以得出题干中的实验结论,因为Br2与I2的氧化性强弱没有实验佐证.因此要设计比较Br2和I2的氧化性强弱的实验步骤,利用氧化性强者制备氧化性弱者的原理,设计实验步骤,
故答案为:没有比较Br2和I2的氧化性强弱;把第③步改为:将溴水滴在淀粉KI试纸上,观察试纸是否变蓝色(或KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色).
点评 本题考查卤素单质之间的置换反应的实验设计,把握单质的氧化性强弱及现象的分析为解答的关键,涉及氧化还原反应氧化性的比较及萃取等知识点,题目难度中档.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热前消耗的多 | |
| B. | 加热后消耗的多 | |
| C. | 加热前后均消耗0.02amolHCl | |
| D. | 当n(NaOH)>n(NaHCO3)时消耗的才会一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) | 0.73 | 1.02 | 1.34 | 1.06 | 0.99 | .5 4 | 0.75 | 1.18 |
| 最高或最 低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
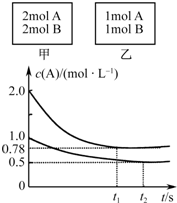 向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )
向甲、乙两个容积均为1L的恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B.相同温度下,发生反应:A(g)+B(g)?xC(g);△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法正确的是( )| A. | 甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙) | |
| B. | x不可能等于2 | |
| C. | 将乙容器升温可使甲、乙容器内各物质的体积分数相同 | |
| D. | 若向甲容器中再充入2mol A、2mol B,则平衡时甲容器中0.78mol•L-1<c(A)<1.56mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和己烷(溴水) | B. | 矿物油和植物油(NaOH溶液) | ||
| C. | 乙醛和丙烯酸(KMnO4溶液) | D. | 硝基苯和CCl4(水) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com