
实验室可用NaNO2+NH4Cl ==NaCl+N2↑+2H2O制备N2,下列说法正确的是
A.NaNO2发生氧化反应
B.NH4Cl中的氮元素被还原
C.N2既是氧化产物,又是还原产物
D.每生成1mol N2转移电子的物质的量为6mol
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.凡是放热反应都是自发的,凡是吸热反应都是非自发的
B.自发反应一定是熵增大的反应,非自发反应一定是熵减小的反应
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:填空题
(8分)化学是一门以实验为基础的学科。
(1)下列描述正确的是_____________(填写序号)。
A.金属钠通常保存在煤油中,防止接触空气而变质
B.容量瓶、分液漏斗在使用时需要检验是否漏水
C.海带提取碘实验中,灼烧海带时需要用到的仪器有玻璃棒、蒸发皿、泥三角、三脚架、酒精灯
D.向含有Fe2+的FeCl3溶液中通入Cl2或滴加H2O2均可以除去Fe2+
E.检验Na2SO3固体是否被氧化:取少量固体溶于水,加入BaCl2溶液,产生白色沉淀,滴加稀硝酸,观察白色沉淀是否溶解
(2)实验室中常用下图仪器制取、净化和收集气体。

①关闭A装置中的止水夹,向分液漏斗中加入适量水,打开活塞,说明A装置气密性良好的现象是_______________________________________。
②实验室可利用A装置在加热条件下制取Cl2,写出该反应的离子方程式__________。
③若用B装置除去SO2中混有的HCl气体,B中盛放试剂的名称为_______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:填空题
(16分)工业上利用废铁屑(含少量氧化铝、氧化铁等)生产硫酸亚铁溶液,进而可制备绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)等重要试剂。生产硫酸亚铁溶液的工艺流程如下:
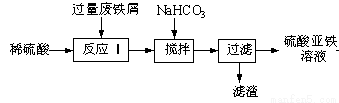
回答下列问题:
(1)加入少量NaHCO3,调节溶液pH的目的是__________________________。
(2)硫酸亚铁溶液在空气中久置容易变质,用离子方程式表示其变质的原因:_____。
(3)若向所得FeSO4溶液中加入少量3 moL? L-1 H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后得到硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)。硫酸亚铁铵较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.352g Cu2S和CuS的混合物在酸性溶液中用40.00 mL0.150 mol?L-1 KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,剩余的KMnO4恰好与50.00mL 0.200 mol?L-1 (NH4)2Fe(SO4)2溶液完全反应。
①配平离子方程式: MnO4-+ Fe2++ H+—— Mn2++ Fe3++ H2O
②Cu2S和CuS的混合物在酸性溶液中用0.150 mol?L-1 KMnO4溶液处理后,溶液需煮沸的原因是:_______________________________________________。
③实验室配制500mL 3 moL? L-1 H2SO4溶液,需要质量分数为98%,密度为1.84g? mL-1硫酸的体积为__________ mL。(保留1位小数)
④试计算混合物中CuS的质量分数(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
某碱性溶液中只含有Na+、CH3COO-、H+、OH-四种离子。下列描述正确的是
A.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
B.该溶液一定由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成
C.该溶液中离子浓度一定为c (Na+)>c(CH3COO-)>c (OH-)>c(H+)
D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列有关物质的性质、制取或应用等的说法中正确的是
A.用10%的盐酸蒸发浓缩获得30%的盐酸
B.水晶项链和餐桌上的瓷盘都是硅酸盐制品
C.可利用丁达尔效应来区别淀粉溶液和氯化钠溶液
D.二氧化硫具有漂白性,与氯水混合使用效果更好
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:填空题
(12分)酸浸法制取硫酸铜的流程示意图如下
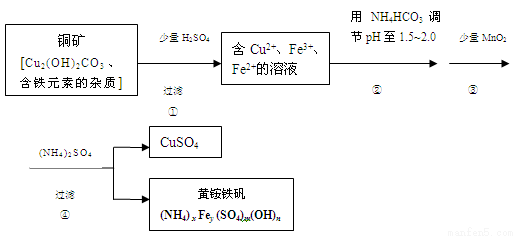
(1)步骤①中Cu2(OH)2CO3 发生反应的化学方程式为 。
(2)在步骤③发生的反应中,1mol MnO2转移2mol 电子,该反应的离子方程式为 。
(3)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取4.800 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
b.量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
b.量取25.00 mL溶液A,加入足量的NaOH溶液充分反应后,过滤、洗涤、灼烧得红色粉末0.600g。
c.另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165 g。
①用Na2S2O3溶液进行滴定时,滴定到终点的颜色变化为 。
②通过计算确定黄铵铁矾的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:选择题
2014年的南京青奥会将秉持“绿色青奥”这一理念,下列行为不符合这一主题的
A.推广使用一次性木筷,减少疾病传染
B.推广使用电动汽车、天然气汽车等环保公共交通工具
C.大力发展太阳能和风力发电机可缓解电力紧张问题
D.将地沟油回收加工为燃料油,提高资源的利用率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港市高三上学期期中化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.Cl-的电子排布式:1s22s22p63s23p6
B.NaCl的电子式为:
C.硫离子的结构示意图:
D.中子数为146的铀(U)原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com