
| A. | 1 L 0.1 mol/L 醋酸中含有CH3COO-数目等于0.1NA | |
| B. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 1 L 0.1 mol•L-1 Na2CO3溶液中含碳微粒总数一定为0.1NA | |
| D. | 1 L 0.1 mol•L-1 Al2(SO4)3溶液中Al3+的数目为0.2NA |
分析 A.醋酸是弱酸,只能部分电离;
B.氢氧化钠溶液中,氢氧根离子抑制了水的电离,溶液中的氢离子是水电离的;
C.由物料守恒得出即可;
D.硫酸铝为强酸弱碱盐,铝离子水解.
解答 解:A.醋酸是弱酸,只能部分电离,故1LpH=1的醋酸溶液中氢离子个数为0.1NA个,但醋酸分子个数无法计算,故A错误;
B.室温下pH=13的NaOH溶液中氢离子浓度为1×10-13mol/L,由于氢氧根离子抑制了水的电离,溶液中氢离子是水电离的,所以由水电离的OH-离子的浓度与溶液中氢离子浓度相同,故B错误;
C.1L 0.1 mol•L-1 Na2CO3溶液中碳原子的物质的量n=1L×0.1mol/L=0.1mol,故1L 0.1mol/L的Na2CO3溶液中含碳微粒总数一定为0.1NA,故C正确;
D.硫酸铝为强酸弱碱盐,铝离子水解,导致溶液中氯离子物质的量小于0.2mol,故D错误,
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3水解:HCO3-+H2O?CO32-+H3O+ | |
| B. | 用石墨作电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 乙醛与新制的Cu(OH)2悬浊液加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
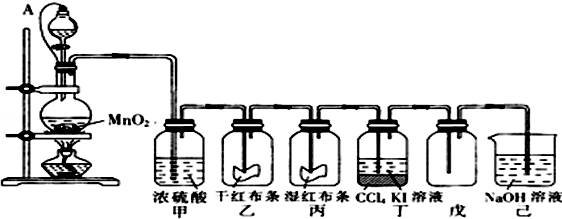
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 可以表示CO2分子或SiO2分子 可以表示CO2分子或SiO2分子 | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | HCO3-的电离方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 含18个中子的氯原子的核素符号:${\;}_{35}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验淀粉是否发生水解,将淀粉与稀硫酸溶液共热,冷却后,取上层水溶液,用NaOH中和稀硫酸后,再加入Cu(OH)2悬浊液,加热,观察是否产生砖红色沉淀 | |
| B. | 检验Fe(NO3)2晶体是否已氧化变质,将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变血红色 | |
| C. | 在酸、碱中和滴定终点时不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量溶液进行调整 | |
| D. | 实验室制备氢氧化亚铁,滴加氢氧化钠溶液时应将胶头滴管插入硫酸亚铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 纯净物 | 纯硫酸 | 冰醋酸 | 水玻璃 | 胆矾 |
| 混合物 | 水煤气 | 福尔马林 | 冰水混合物 | 漂白粉 |
| 弱电解质 | 氨水 | 氟化氢 | 氨 | 水 |
| 非电解质 | 干冰 | 乙醇 | 三氧化硫 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
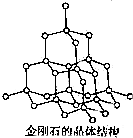 CH4、NH3、H20和HF均为含10e-的分子.
CH4、NH3、H20和HF均为含10e-的分子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com