
分析 (1)含自由移动离子和电子的物质能导电;
(2)在水溶液中或熔融状态下能导电的化合物为电解质;
(3)在水溶液中或熔融状态下能导电的化合物为电解质;在水溶液中和熔融状态下能导电的化合物为非电解质,据此分析.
解答 解:①NaNO3固体不能导电,是电解质;
②熔融KCl能导电,是电解质;
③液氨不能导电,是非电解质;
④石墨是单质,能导电,既不是电解质也不是非电解质;
⑤氯化氢不能导电,是电解质;
⑥盐酸是溶液,能导电,既不是电解质也不是非电解质;
⑦蔗糖不能导电,是非电解质.
(1)能导电的是②④⑥,故答案为:②④⑥;
(2)是电解质的是①②⑤,故答案为:①②⑤;
(3)既不是电解质也不是非电解质的是④⑥,故答案为:④⑥.
点评 本题考查了电解质、非电解质的概念,难度不大,应注意的是电解质不一定能导电,能导电的不一定是电解质.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molH2O含有的原子数目为1.5NA | B. | 0.5molNH3含有的电子数目为4NA | ||
| C. | 28gCO含有的分子数目为NA | D. | 2NA个氯气分子的物质的量是2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 四氯化碳(CCl4)含有的碳原子数目为NA | |
| B. | CO2通过Na2O2使其增重5.6g时,反应中转移的电子数为0.4 NA | |
| C. | 0.2mol Fe与0.2 mol Cl2反应时失电子数为0.6NA | |
| D. | 常温常压下,29.8 g KCl与NaClO的固体混合物中阴离子的数目为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20 mol、0.60 mol、0.20mol | B. | 0.30 mol、0.60 mol、0.10 mol | ||
| C. | 0.40 mol、0.60 mol、0.10 mol | D. | 0.20 mol、0.10mol、0.60 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
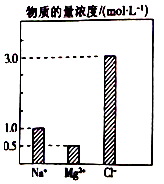 在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分,下列说法不正确的是( )
在0.2L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,对于该溶液成分,下列说法不正确的是( )| A. | NaCl的物质的量为0.2mol | |
| B. | 溶质MgCl2的质量为9 g | |
| C. | 该混合液中BaCl2的物质的量为0.1mol | |
| D. | 将该混合液加水稀释至体积为1 L,稀释后溶液中的Ba2+物质的量浓度为0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)=2H2O(l)△H=+484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com