
(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的元素符号为 ▲ ;M在元素周期表中的位置为 ▲ ;五种元素的原子半径从大到小的顺序是 ▲ (用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为 ▲ ,B的结构式为 ▲ 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ▲ 。
(4)写出由X、Z、L三种元素组成的离子化合物与稀NaOH溶液反应的离子方程式:
▲ 。
(5)Z2H4和ZO2是一种双组分火箭推进剂。两种物质混合发生反应生成Z2和X2O(g),已知8g气体Z2H4在上述反应中放出142kJ热量,其热化学方程式为 ▲ 。
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源:2013届宁夏银川一中高三第一次月考理综化学试卷(带解析) 题型:实验题
(14分)X、Y、Z、W、G、和H均由短周期元素组成,它们是中学化学中常见的气体,具有如下性质:
①X、Y、G能使湿润的蓝色石蕊试纸变红,H能使湿润的红色石蕊试纸变蓝,Z、W不能使湿润的石蕊试纸变色;
②X和H相遇产生白烟;
③Y是形成酸雨的主要气体且能使品红溶液褪色;
④Z和W相遇生成红棕色气体;
⑤G在W中燃烧可以产生Y和H2O;
⑥回答下列问题:
(1) H的化学式是__________,
实验室制取H的化学反应方程式是___________________________________________;
(2)Z的化学式是________,W的化学式是__________________;
(3)⑤中发生反应的化学方程式是___________________________________________;
(4)实验室制备、收集干燥的Y气体,所需仪器如下。装置A产生Y气体,按气流方向连接各仪器接口,顺序为a
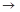 f:
f:
装置D的作用是_ ___,装置E中NaOH溶液的作用是__ ____。
查看答案和解析>>
科目:高中化学 来源:2012届安徽省黄山市高三七校联考化学试卷 题型:填空题
(14分)X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 原子最外层电子数是次外层的三倍 |
| Z | 单质及其化合物的焰色反应为黄色 |
| W | W元素基态原子的M层全充满,N层只有一个电子 |
 。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。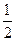 O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1
O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省黄山市高三七校联考化学试卷 题型:填空题
(14分)X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
原子最外层电子数是次外层的三倍 |
|
Z |
单质及其化合物的焰色反应为黄色 |
|
W |
W元素基态原子的M层全充满,N层只有一个电子 |
⑴ X位于元素周期表第 族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
⑵ X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 个σ键。
⑶Z2Y2中含有的化学键类型有 。阴、阳离子的个数比为 。
⑷W的基态原子核外电子排布式是 。
⑸废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
A(s)+H2SO4 (aq) == ASO4(aq) + H2(g) ΔH=+64.4kJ·mol-1
2H2O2(l) == 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
H2(g)+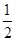 O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):
。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年安徽省合肥市高三第二次教学质量检测理综化学部分 题型:填空题
(14分)X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少、构成蛋白质的重要组成元素;Z的基态原子核外9个轨道上填充了电子,且核外有2个未成对电子,与Y不同族;W是一种常见元素,可以形成3种氧化物,其中一种氧化物是具有磁性的黑色晶体。
(1) 常温常压下Z单质是_______晶体(填类型),微粒间通过______形成晶体(填微粒间相互作用的类型)。Y2分子中存在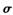 键和
键和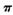 键个数之比为____________。
键个数之比为____________。
(2) X-H和Y—H属于极性共价键,其中极性较强的键是______(X、Y用元素符号表示)。X的第一电离能比Y的______(填“大”或“小“)。
(3) 写出X单质与Z的最高价氧化物对应的水化物的浓溶液反应的化学方程式____________________________________________________________
(4) W的基态原子的外围电子排布式是____________。
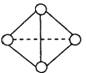
(5) 已知一种分子Y4分子结构如上图所示:断裂1molY—Y吸收167KJ的热量,生成1molY Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式________________________
Y放出942KJ热量。试写出由Y4气态分子变成Y2气态分子的热化学方程式________________________
查看答案和解析>>
科目:高中化学 来源:2010-2011年福建省高一下学期期末考试化学试卷 题型:填空题
(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期中金属性最强的元素。回答下列问题:
(1)L的元素符号为 ;M在元素周期表中的位置为 ;L和M元素的离子半径大小顺序是 (用离子符号表示)。
(2)Z、X两元素按原子数目比l∶3构成分子A,A的电子式为 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则硒的最高价氧化物的水化物化学式为 。
(4)由X、Z、L三种元素组成的离子化合物与稀NaOH溶液共热可生成使红色石蕊试纸变蓝的气体,写出该反应的离子方程式: 。
(5)写出由M、L元素组成的物质的电子式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com