
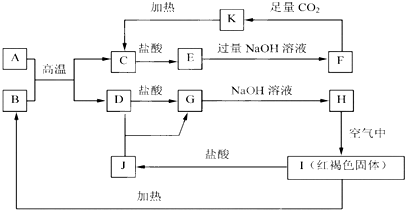
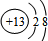 ��
������ IΪ���ɫ���壬ӦΪFe��OH��3����HΪFe��OH��2��GΪFeCl2��DΪFe��JΪFeCl3��BΪFe2O3��A��B�ķ�ӦΪ���ȷ�Ӧ��AΪAl��CΪAl2O3��EΪAlCl3��KΪAlOH��3��FΪNaAlO2�����������ʵ������Լ���ĿҪ��ɽ����⣮
��� �⣺IΪ���ɫ���壬ӦΪFe��OH��3����HΪFe��OH��2��GΪFeCl2��DΪFe��JΪFeCl3��BΪFe2O3��A��B�ķ�ӦΪ���ȷ�Ӧ��AΪAl��CΪAl2O3��EΪAlCl3��KΪAlOH��3��FΪNaAlO2��
��1��EΪAlCl3��������ΪAl3+�����ӵĽṹʾ��ͼΪ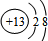 ���ʴ�Ϊ��
���ʴ�Ϊ��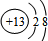 ��
��
��2��AΪ��Al����BΪ��Fe2O3�����ķ�Ӧ�ڹ�ҵ��Ҳ�������ȷ�Ӧ����Ӧ�Ļ�ѧ����ʽΪ��2Al+Fe2O3$\frac{\underline{\;����\;}}{\;}$2Fe+Al2O3���ʴ�Ϊ��2Al+Fe2O3$\frac{\underline{\;����\;}}{\;}$2Fe+Al2O3��
��3��Fe��OH��2���л�ԭ�ԣ���������е���������������ԭ��Ӧ����Fe��OH��3����Ӧ�ķ���ʽΪ4Fe��OH��2+O2+2H2O=4Fe��OH��3��
�ʴ�Ϊ��4Fe��OH��2+O2+2H2O=4Fe��OH��3��
��4��JΪFeCl3����FeCl3���е�������Fe3+������취��ȡ������Һ��С�Թ��У��μӼ���KSCN��Һ������Һ���ֺ�ɫ��˵������Fe3+��
�ʴ�Ϊ��ȡ������Һ��С�Թ��У��μӼ���KSCN��Һ������Һ���ֺ�ɫ��˵������Fe3+��
���� ����������ͼ�ƶ��⣬���������ƶ������ʣ��ѶȽϴ�����Ԫ�ػ�����������ǽ���Ĺؼ�����Ҫѧ����������Ԫ�ػ�����֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼����������Ҫ�ɷ���ͬ������������ͬ | |
| B�� | þ���Ͻ����������ɻ��������Ȳ��� | |
| C�� | ͭ�Ͻ��������ĵ��硢�������ܣ�����ʴ�������ϲ� | |
| D�� | �����Ͻ���кܸߵ��۵㣬�����������������ϣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
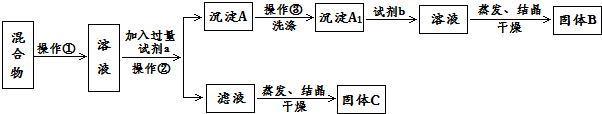
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
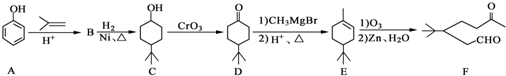
 ��
�� ��ͬʱ��������������B��ͬ���칹�壨������B������11�֣�����FeCl3��Һ����ɫ��������ֻ������ȡ������
��ͬʱ��������������B��ͬ���칹�壨������B������11�֣�����FeCl3��Һ����ɫ��������ֻ������ȡ������ ����дһ�֣���
����дһ�֣���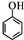 ����CH2=CH2Ϊԭ���Ʊ��л���
����CH2=CH2Ϊԭ���Ʊ��л���  �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 35g | B�� | 30g | C�� | 20g | D�� | 15g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
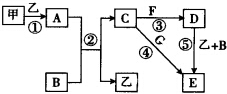 ���п�ͼ�е����ʾ�Ϊ��ѧ��ѧ�г������ʣ����мס���Ϊ���ʣ������Ϊ�����BΪ����Һ̬�����AΪ����ɫ���壬F��G����Ԫ����ͬ�Ҿ�Ϊ�Ȼ��G��KSCN��Һ�Ժ�ɫ��
���п�ͼ�е����ʾ�Ϊ��ѧ��ѧ�г������ʣ����мס���Ϊ���ʣ������Ϊ�����BΪ����Һ̬�����AΪ����ɫ���壬F��G����Ԫ����ͬ�Ҿ�Ϊ�Ȼ��G��KSCN��Һ�Ժ�ɫ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
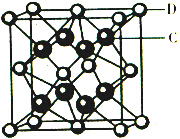 ��֪A��B��C��D��E����Ԫ�����ڱ���ǰ36�ŵ�Ԫ�أ����ǵ�ԭ��������������Aԭ�ӻ�̬ʱ���������������ڲ����������2����Bԭ�ӻ�̬ʱs��������P��������ȣ�C��Ԫ�����ڱ��ĸ�Ԫ���е縺�����D�Ļ�̬ԭ�Ӻ�����6���ܼ���ȫ���������ӣ�Eԭ�ӻ�̬ʱδ�ɶԵ�������ͬ����Ԫ�������ģ�Fԭ�Ӻ���������������Na��ͬ�����������Ӿ�������
��֪A��B��C��D��E����Ԫ�����ڱ���ǰ36�ŵ�Ԫ�أ����ǵ�ԭ��������������Aԭ�ӻ�̬ʱ���������������ڲ����������2����Bԭ�ӻ�̬ʱs��������P��������ȣ�C��Ԫ�����ڱ��ĸ�Ԫ���е縺�����D�Ļ�̬ԭ�Ӻ�����6���ܼ���ȫ���������ӣ�Eԭ�ӻ�̬ʱδ�ɶԵ�������ͬ����Ԫ�������ģ�Fԭ�Ӻ���������������Na��ͬ�����������Ӿ�������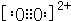 ��1mol B22+�к��еĦм���ĿΪ2NA��
��1mol B22+�к��еĦм���ĿΪ2NA�� �����ӻ����ᄃ����ܶ�Ϊa g/cm3�����������$\frac{312}{a{N}_{A}}$ cm3��ֻҪ������ʽ�������ӵ�������ֵΪNA����
�����ӻ����ᄃ����ܶ�Ϊa g/cm3�����������$\frac{312}{a{N}_{A}}$ cm3��ֻҪ������ʽ�������ӵ�������ֵΪNA�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com