
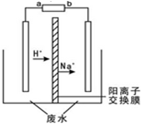
 2016年两会3月2日在北京拉开帷幕,在涉及国计民生的众多提案中,“水资源的保护和合理利用”仍然是人民群众关注的焦点.最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应如下:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.下列有关说法不合理的是( )
2016年两会3月2日在北京拉开帷幕,在涉及国计民生的众多提案中,“水资源的保护和合理利用”仍然是人民群众关注的焦点.最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应如下:2CH3CHO+H2O$\frac{\underline{\;电解\;}}{\;}$CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.下列有关说法不合理的是( )| A. | 若以锌-锰碱性电池为直流电源,则b极材料为Zn | |
| B. | 已知乙醛、乙醇的沸点分别为20.8℃、78.4℃,从电解后的溶液中分离出乙醇粗产品的方法是蒸馏 | |
| C. | 若反应过程中每生成1mol乙醇,理论上至少消耗氢气11.2L | |
| D. | 电解过程中,阳极除生成氧气外,还发生如下反应:CH3CHO+2H2O-2e-=CH3COOH+2H+ |
分析 A、由图可知,H+与Na+移向右侧,故右侧电极做阴极,则a为锌-锰碱性电池的正极,b电极为锌-锰碱性电池的负极;
B、乙醇和乙醛的沸点相差较大,要分离二者应该采用蒸馏;
C、阴极发生如下反应:4H++4e-=2H2↑,CH3CHO+2e-+2H2O=CH3CH2OH+2OH-,据此计算;
D、电解池中阳极失去电子,阳极有OH-放电,同时乙醛也失去电子,被氧化生成乙酸.
解答 解:A、由图可知,H+与Na+移向右侧,故右侧电极做阴极,则a为锌-锰碱性电池的正极,b电极为锌-锰碱性电池的负极,故b选Zn棒,故A正确;
B、根据乙醇和乙醛的沸点相差较大可知,若要分离二者应该采用蒸馏,故B正确;
C、阴极发生如下反应:4H++4e-=2H2↑,CH3CHO+2e-+2H2O=CH3CH2OH+2OH-,若反应过程中每生成1mol乙醇,理论上至少消耗氢气11.2L(标准状况),故C错误;
D、电解池中阳极失去电子,阳极有OH-放电:4OH--4e-=O2↑+2H2O,同时乙醛也失去电子,被氧化生成乙酸,方程式为CH3CHO+2H2O-2e-=CH3COOH+2H+,故D正确.
故选C.
点评 本题考查了电解池的工作原理知识,侧重于学生的分析能力的考查,明确电极上发生的反应是解题关键,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3:1 | B. | 1:3:2 | C. | 2:3:3 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 香蕉、苹果等食物存放在冰箱里 | |
| B. | 服用钙片要充分咀嚼后再吞服 | |
| C. | 用铁桶(或铝桶)存放浓硫酸 | |
| D. | 我国在西周时期发明的“酒曲”酿酒工艺 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | W | |||
| Y | Z |
| A. | X元素形成的氢化物液态比固态的密度小 | |
| B. | 四种元素行成的简单离子半径从大小的排列顺序Y>Z>X>W | |
| C. | 常温下,Y形成的简单离子和W形成的简单离子在水溶液中可以大量共存 | |
| D. | Y常用于冶炼难熔的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 茶 | B. | 西瓜 | C. | 大豆 | D. | 甜菜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com