
| 实验编号 | c(HA)/mol•L-1) | c(NaOH)/mol•L-1 | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
| 丁 | 0.1 | 0.1 | pH=c |
| A. | 甲中:若a=7,则HA是强酸 | |
| B. | 乙中:若b≠0.2,则c(A-)=C(Na+) | |
| C. | 丙中:若HA是弱酸,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$<1 | |
| D. | 丁中:若 c=9,则c(OH-)-c(HA)=10-9mol/L |
分析 A.甲中二者恰好反应生成NaA,若a=7,说明反应后溶液呈中性,则NaA为强碱强酸盐;
B.常温下溶液的pH=7,则c(OH-)=c(H+),结合电荷守恒判断;
C.丙中反应后溶质为等浓度的HA和NaA,反应后溶液呈酸性,说明HA的电离程度大于A-的水解程度,则c(A-)>c(HA);
D.丁中二者恰好反应生成NaA,结合质子守恒判断.
解答 解:A.常温下,将某一元酸HA和NaOH溶液等体积、等浓度混合,甲中若a=7,说明二者反应生成的NaA为强碱强酸盐,则HA是强酸,故A正确;
B.乙中反应后溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒可知:c(A-)=c(Na+),故B正确;
C.丙中反应后溶质为等浓度的HA和NaA,反应后溶液的pH<7,呈酸性,说明HA的电离程度大于A-的水解程度,则c(A-)>c(HA),所以$\frac{c({A}^{-})}{c(HA)}$>1,故C错误;
D.丁中反应后溶质为NaA,c=9时c(H+)=10-9mol/L,根据质子守恒可知:c(OH-)=c(H+)+c(HA),则c(OH-)-c(HA)=c(H+)=10-9mol/L,故D正确;
故选C.
点评 本题考查溶液酸碱性与溶液pH的关系,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物质的量及质子守恒的含义及应用方法,试题培养了学生水的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车 | |
| B. | 高纯硅可以将太阳能直接转化为电能 | |
| C. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| D. | 工业上Cl2用与石灰乳反应制备漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
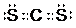 ,该分子为非极性(选填“极性”、“非极性”)分子.
,该分子为非极性(选填“极性”、“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 | |
| B. | 电池的正极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 电解后c(Na2CO3)不变,且溶液中有晶体析出 | |
| D. | 电池中c(KOH)不变;电解池中溶液pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2(s)+2CO2( s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| B. | CO的燃烧热为283 kJ | |
| C. | 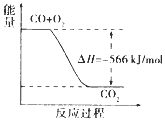 如图可表示由CO生成CO2的反应过程和能量关系 | |
| D. | CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×l023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
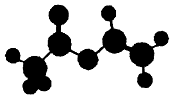 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物与Br2的四氯化碳溶液不反应 | |
| C. | 该化合物既能发生水解反应,又能发生氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
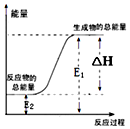
| A. | 锌粒和稀硫酸反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com