
关于下列各装置图的叙述中,不正确的是

A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
科目:高中化学 来源:2014-2015广东省汕头市高一上学期10月月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值。下列说正确的是
A.高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3NA
B.78g过氧化钠中含阴离子数为2 NA
C.C2H4和N2组成的42g混合气体中原子的个数为3 NA
D.5NH4 NO3 2HNO3 + 4N2↑+ 9H2O反应中,生成28gN2 时,转移的电子数目为3.75NA
2HNO3 + 4N2↑+ 9H2O反应中,生成28gN2 时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三上学期期末考试化学试卷(解析版) 题型:选择题
能用溴水鉴别的是
A.甲烷、乙烯 B.甲烷、乙烷
C.NaCl溶液、KCl溶液 D.MgSO4溶液、Mg(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源:2015年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:实验题
(14分)肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。CO(NH2) + 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是 ;
实验二:制取水合肼(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO=N2↑ + 3H2O + 2NaCl)
(2)分液漏斗中的溶液是 (填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是 ;
实验三:测定馏分中肼含量水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液。
b.移取25.00 mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式 ;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(4)滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”);若本次滴定消耗碘的标准溶液为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 (保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是: 。
查看答案和解析>>
科目:高中化学 来源:2015年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.四氯化碳分子比例模型:
B.COS的电子式是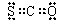
C.次氯酸的结构式为H-Cl-O
D. O2-离子结构示意图:
O2-离子结构示意图: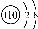
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市七校高三上学期期末联考理综化学试卷 (解析版) 题型:选择题
设NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4 L水所含电子数约为10 NA
B.25℃时,pH=13的1 L Ca(OH)2溶液中含有OH-数目约为0.2 NA
C.0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA
D.常温常压下,3.2 g O2和O3混合气体含有0.2 NA个氧原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省协作体高三上学期第二次月考化学试卷(解析版) 题型:选择题
某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,Fe又开始溶解,Cu不溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:选择题
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示)。已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是

A.只用盐酸一种试剂就可以确定该固体M的具体成分
B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
C.往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4
D.用pH试纸检验,若常温下pH=7,则固体M一定是Na2SO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
(10分)某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com