
分析 (1)依据已知化学方程式构建目标方程式,根据盖斯定律计算得到△H;
(2)以C3H8为原料制作的燃料电池,负极通入丙烷,碳元素的化合价升高,电池的正极通入O2,氧元素的化合价降低,以此来书写电池总反应方程式,原电池中阴离子向负极移动;
(3)常温下,NaHCO3溶液的pH大于8,说明溶液中HCO3-水解程度大于电离程度导致溶液呈碱性,根据NaHCO3溶液的中HCO3-的水解程度大于自身的电离程度来回答c(H2CO3)、c(CO32-)相对大小.
解答 解:(1)已知①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ/mol
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ/mol
依据盖斯定律①-②得到C3H8(g)→CH3CH=CH2(g)+H2(g)△H=(156.6kJ/mol )-(32.4kJ/mol)=+124.2KJ/mol,
故答案为:+124.2KJ/mol;
(2)以C3H8为原料制作的燃料电池,负极通入丙烷,碳元素的化合价升高,电池的正极通入O2,氧元素的化合价降低,即丙烷与氧气反应生成二氧化碳和水,则电池的总反应为C3H8+5O2═3CO2+4H2O,原电池中阴离子向负极移动,即CO32-移向电池的负极,
故答案为:C3H8+5O2═3CO2+4H2O;负;
(3)常温下,NaHCO3溶液的pH大于8,说明溶液中HCO3-水解程度大于电离程度导致溶液呈碱性,水解平衡为HCO3-+H2O?H2CO3+OH-,因NaHCO3溶液显碱性,HCO3-的水解程度大于自身的电离程度,即NaHCO3溶液中既存在电离平衡为HCO3-?CO32-+H+,水解平衡为HCO3-+H2O?H2CO3+OH-,而HCO3-水解程度大于电离程度,所以c(H2CO3)>c(CO32-),
故答案为:HCO3-+H2O?H2CO3+OH-;>.
点评 本题考查了反应热的计算、燃料电池的工作原理、盐类水解的分析,为高频考点,明确溶质性质是解本题关键,易错点是比较c(H2CO3)、c(CO32-)相对大小,侧重考查学生分析判断能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: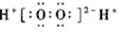 | B. | CCl4的电子式: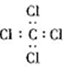 | ||
| C. | ${\;}_{\;}^{18}$O的原子结构示意图: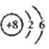 | D. | MgCl2的电子式: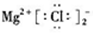 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 所选主要仪器(铁架台等忽略) | 部分操作 |
| A | 用浓硫酸配制480mL0.1mol/L硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸放入容量瓶中,加水溶解至刻度线 |
| B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
| C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管 | 温度计水银球插入液液面以下 |
| D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
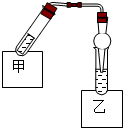 如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上.
如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
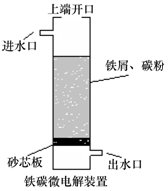
| A. | 无论是否鼓入空气,负极的电极反应式均为Fe-2e-═Fe2+ | |
| B. | 不鼓入空气时,正极的电极反应式为H++e-═H | |
| C. | 鼓入空气时,每生成1mol•OH有2mol电子发生转移 | |
| D. | 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C为不同核素 | B. | 石墨和C60互为同素异形体 | ||
| C. | O2和O3互为同位素 | D. | ${\;}_{17}^{35}$X与${\;}_{17}^{37}$Y 为同种元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com