
分析 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,则A为H元素,C为O元素;C与E同主族,则E为S元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,D、E、F同周期,则D为Na,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素.
解答 解:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,则A为H元素,C为O元素;C与E同主族,则E为S元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,D、E、F同周期,则D为Na,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故上述A~F六种元素原子,原子半径最大的是Na,故答案为:Na;
(2)A与B两种元素组成一种阳离子,该离子符号为NH4+,故答案为:NH4+;
(3)C、D两种元素组成的化合物的化学式是Na2O、Na2O2,故答案为:Na2O、Na2O2;
(4)同周期自左而右元素非金属性增强,故非金属性Cl>S,能够证明这一结论的化学事实是:高氯酸的酸性比硫酸的酸性强,
故答案为:Cl;高氯酸的酸性比硫酸的酸性强.
点评 本题考查位置结构性质的关系及应用,推断元素的推断是解题的关键,A与C形成的化合物常温下为液态是推断突破口,注意掌握金属性、非金属性强弱比较实验事实.


科目:高中化学 来源: 题型:选择题
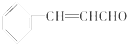
| A. | 煮沸肉桂醛与新制Cu(OH)2的混合物有砖红色沉淀生成 | |
| B. | 电解肉桂醇制得的肉桂醛在电解池的阳极生成 | |
| C. | 仅用新制银氨溶液和溴水不能鉴别肉桂醛中的碳碳双键 | |
| D. | 13.2g肉桂醛分子中含有碳碳双键数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g氮气含有的原子数为NA | |
| B. | 标准状况下22.4L水中含有的水分子数为NA | |
| C. | 1molOH-含有的电子数为10NA | |
| D. | 0.1L 1mol/L NaCl溶液中含有Na+个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
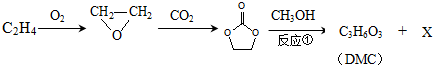
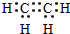 ;石油工业上获得C2H4的操作名称为:石油裂解
;石油工业上获得C2H4的操作名称为:石油裂解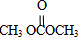

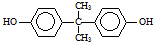 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: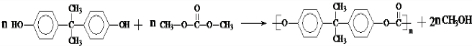 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 云母是热的不良导体.传热不均匀 | |
| B. | 石蜡是热的不良导体.传热不均匀 | |
| C. | 石蜡具有各向异性,不同的方向导热性不同 | |
| D. | 云母具有各向异性,不同的方向导热性不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
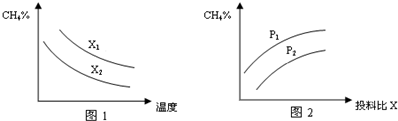
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏操作时,温度计的水银球要插入溶液中 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用分液漏斗分离水和四氯化碳时,水从上口倒出,四氯化碳从下口放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com