
”¾ĢāÄæ”æ£Ø1£©ŗ¬ÓŠ6.02”Į1023øöHµÄH2O£¬ĘäĪļÖŹµÄĮæŹĒ________ mol£»ŗ¬ÓŠ0.4 molAl3£«µÄAl2(SO4)3ČÜŅŗÖŠĖłŗ¬SO42£µÄøöŹżŹĒ________
£Ø2£©0.3 mol NH3·Ö×ÓÖŠĖłŗ¬Ō×ÓŹżÓė_______ molH2O·Ö×ÓÖŠĖłŗ¬Ō×ÓŹżĻąµČ”£
£Ø3£©ŅŖŹ¹NH3ÓėCH4ŗ¬ĻąĶ¬ŹżÄæµÄHŌ×Ó£¬ŌņNH3ŗĶCH4µÄĪļÖŹµÄĮæÖ®±ČĪŖ__________”£
£Ø4£©Ä³½į¾§Ė®ŗĻĪļµÄ»ÆѧŹ½ĪŖA”¤nH2O£¬AµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖM”£Čē½«a gøĆ»ÆŗĻĪļ¼ÓČČÖĮ½į¾§Ė®Č«²æŹ§Č„£¬Ź£ÓąµÄ²ŠŌüĪŖb g£¬Ōņn£½________”£
£Ø5£©ŌŚĶ¬ĪĀĶ¬Ń¹ĻĀ£¬Ä³ĘųĢåXÓėH2ĘųĢåµÄĆܶČÖ®±ČĪŖ14£ŗ1£¬ŌņĘųĢåXµÄ·Ö×ÓŹ½æÉŅŌŹĒ_______________£ØÖĮÉŁŠ“³öĮ½ÖÖ£©”£
”¾“š°ø”æ 0.5 3.612”Į1023 0.4 4”Ć3 (a-b)M/18b CO”¢N2
”¾½āĪö”æ(1)6.02”Į1023øöHµÄĪļÖŹµÄĮæn=![]() =
=![]() =1mol£¬ÓÉÓŚ1molĖ®ÖŠŗ¬2molĒāŌ×Ó£¬¹Źŗ¬1molĒāŌ×ÓµÄĖ®µÄĪļÖŹµÄĮæĪŖ0.5mol£»ŗ¬ÓŠ0.4 molAl3£«µÄČÜŅŗÖŠn[Al2(SO4)3]=
=1mol£¬ÓÉÓŚ1molĖ®ÖŠŗ¬2molĒāŌ×Ó£¬¹Źŗ¬1molĒāŌ×ÓµÄĖ®µÄĪļÖŹµÄĮæĪŖ0.5mol£»ŗ¬ÓŠ0.4 molAl3£«µÄČÜŅŗÖŠn[Al2(SO4)3]= ![]() n(Al3£«)=
n(Al3£«)= ![]() ”Į0.4 mol=0.2mol£¬Ėłŗ¬SO42£µÄµÄĪļÖŹµÄĮæĪŖ0.2mol”Į3=0.6mol£¬ŹżÄæĪŖ0.6mol”Į6.02”Į1023mol1= 3.612”Į1023£¬¹Ź“š°øĪŖ£ŗ0.5mol£»3.612”Į1023£»
”Į0.4 mol=0.2mol£¬Ėłŗ¬SO42£µÄµÄĪļÖŹµÄĮæĪŖ0.2mol”Į3=0.6mol£¬ŹżÄæĪŖ0.6mol”Į6.02”Į1023mol1= 3.612”Į1023£¬¹Ź“š°øĪŖ£ŗ0.5mol£»3.612”Į1023£»
(2)0.3mol NH3·Ö×ÓÖŠŗ¬ÓŠµÄŌ×ÓµÄĪļÖŹµÄĮæĪŖ0.3mol”Į4=1.2mol£¬Ōņn(H2O)= ![]() =0.4mol£¬¹Ź“š°øĪŖ£ŗ0.4£»
=0.4mol£¬¹Ź“š°øĪŖ£ŗ0.4£»
(3)NH3ÓėCH4ÖŠĒāŌ×ÓøöŹżÖ®±ČĪŖ3£ŗ4£¬¹ŹŅŖŹ¹NH3ÓėCH4ŗ¬ĻąĶ¬ŹżÄæµÄHŌ×Ó£¬ŌņNH3ŗĶCH4µÄĪļÖŹµÄĮæÖ®±ČĪŖ4£ŗ3£¬¹Ź“š°øĪŖ£ŗ4£ŗ3£»
(4)½āČČŹ±£¬½į¾§Ė®ŗĻĪļAnH2O·Ö½ā£¬agøĆ»ÆŗĻĪļ¼ÓČČÖĮ½į¾§Ė®Č«²æŹ§Č„£¬Ź£ÓąµÄ²ŠŌüĪŖbg£¬Ōņ£ŗm(A)=bg£¬m(H2O)=ag-bg£¬Ōņ£ŗn(A)= ![]() mol£¬n(H2O)=
mol£¬n(H2O)= ![]() mol£¬¹Źn=
mol£¬¹Źn=![]() =
=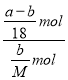 =
=![]() £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ ![]() £»
£»
(5)ŌŚĶ¬ĪĀĶ¬Ń¹ĻĀ£¬Ä³ĘųĢåXÓėH2ĘųĢåµÄĆܶČÖ®±ČĪŖ14£ŗ1£¬øł¾ŻĶ¬ĪĀĶ¬Ń¹ĻĀ£¬ĘųĢåµÄĆܶČÖ®±ČµČÓŚĻą¶Ō·Ö×ÓÖŹĮæÖ®±Č£¬øĆĘųĢåµÄĻą¶Ō·Ö×ÓÖŹĮæ=14”Į2=28£¬øĆĘųĢåæÉÄÜŹĒCO”¢N2”¢C2H4µČ£¬¹Ź“š°øĪŖ£ŗCO”¢N2(ĘäĖūŗĻĄķ“š°ø¾łæÉ)”£


 ²½²½øß“ļ±ź¾ķĻµĮŠ“š°ø
²½²½øß“ļ±ź¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠŹōÓŚĄė×Ó»ÆŗĻĪļŹĒ( )
¢ŁMgF2 ¢ŚNa2O2 ¢ŪKOH ¢ÜCO2 ¢ŻNaClO ¢ŽH2SO4
A. ¢Ś¢Ū¢ŻB. ¢Ś¢Ū¢Ü¢ŻC. ¢Ł¢Ś¢Ū¢ŻD. ¢Ł¢Ū¢Ż¢Ž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄųļÓ£ØNi”ŖCd£©æɳäµēµē³ŲŌŚĻÖ“śÉś»īÖŠÓŠ¹ć·ŗÓ¦ÓĆ”£ŅŃÖŖijÄųļÓµē³ŲµÄµē½āÖŹČÜŅŗĪŖKOHČÜŅŗ£¬Ęä³ä”¢·Åµē°“ĻĀŹ½½ųŠŠ£ŗCd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2”£ÓŠ¹ŲøƵē³ŲµÄĖµ·ØÕżČ·µÄŹĒ
Cd(OH)2 + 2Ni(OH)2”£ÓŠ¹ŲøƵē³ŲµÄĖµ·ØÕżČ·µÄŹĒ
A£®³äµēŹ±Ńō¼«·“Ó¦£ŗNi(OH)2 £e”Ŗ + OH- = NiOOH + H2O
B£®³äµē¹ż³ĢŹĒ»ÆѧÄÜ×Ŗ»ÆĪŖµēÄܵĹż³Ģ
C£®·ÅµēŹ±øŗ¼«ø½½üČÜŅŗµÄ¼īŠŌ²»±ä
D£®·ÅµēŹ±µē½āÖŹČÜŅŗÖŠµÄOH-ĻņÕż¼«ŅʶÆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©CuSO4µÄĖ®ČÜŅŗ³Ź______(Ģī”°Ėį”±”°ÖŠ”±»ņ”°¼ī”±)ŠŌ£¬ŌŅņŹĒ(ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾)___________£»ŹµŃéŹŅŌŚÅäÖĘCuSO4ČÜŅŗŹ±£¬³£ĻČ½«CuSO4¹ĢĢåČÜÓŚ½ĻÅصÄĮņĖįÖŠ£¬Č»ŗóÓĆÕōĮóĖ®Ļ”ŹĶµ½ĖłŠčµÄÅØ¶Č£¬ŅŌ_____ (Ģī”°“Ł½ų”±»ņ”°ŅÖÖĘ”±)ĘäĖ®½ā”£
£Ø2£©ÅŻÄĆš»šĘ÷µÄĆš»šŌĄķŹĒ(ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾)________________________”£
£Ø3£©ŅŃÖŖŌŚ25”ę£ŗAgCl(s)![]() Ag£«(aq)£«Cl£(aq) Ksp=1.8”Į10£10£¬Ag2S(s)
Ag£«(aq)£«Cl£(aq) Ksp=1.8”Į10£10£¬Ag2S(s) ![]() 2Ag£«(aq)£«S2£(aq) Ksp=6.3”Į10£50£¬ĻņÅØ¶Č¾łĪŖ0.001 mol/LµÄNaClŗĶNa2SµÄ»ģŗĻČÜŅŗÖŠ£¬ÖšµĪ¼ÓČėAgNO3ČÜŅŗ£¬×īĻČ²śÉśµÄ³ĮµķŹĒ________£ØĢī”°AgCl”±»ņ”°Ag2S”±£©”£
2Ag£«(aq)£«S2£(aq) Ksp=6.3”Į10£50£¬ĻņÅØ¶Č¾łĪŖ0.001 mol/LµÄNaClŗĶNa2SµÄ»ģŗĻČÜŅŗÖŠ£¬ÖšµĪ¼ÓČėAgNO3ČÜŅŗ£¬×īĻČ²śÉśµÄ³ĮµķŹĒ________£ØĢī”°AgCl”±»ņ”°Ag2S”±£©”£
£Ø4£©Č¼ĮĻµē³ŲÄÜĮæ×Ŗ»ÆĀŹøߣ¬¾ßÓŠ¹ćĄ«µÄ·¢Õ¹Ē°¾°”£ĢģČ»ĘųČ¼ĮĻµē³ŲÖŠ£¬ŌŚøŗ¼«·¢Éś·“Ó¦µÄĪļÖŹŹĒ _____£ØĢī»ÆѧŹ½£©£»Čē¹ūøƵē³ŲÖŠµÄµē½āÖŹČÜŅŗŹĒKOHČÜŅŗ£¬µē¼«Bµē¼«ÉĻ·¢ÉśµÄµē¼«·“Ó¦Ź½ŹĒ£ŗ_____________”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼ČæÉÓĆÅÅĖ®·ØÓÖæÉÓĆÅÅæÕĘų·ØŹÕ¼ÆµÄĘųĢåŹĒ
A.H2B.HClC.NO2D.N2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮŖ°±£ØÓÖ³ĘĮŖėĀ£¬N2H4£¬ĪŽÉ«ŅŗĢ壩ŹĒŅ»ÖÖÓ¦ÓĆ¹ć·ŗµÄ»Æ¹¤ŌĮĻ£¬æÉÓĆ×÷»š¼żČ¼ĮĻ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ĮŖ°±·Ö×ӵĵē×ÓŹ½ĪŖ_____________£¬ĘäÖŠµŖµÄ»ÆŗĻ¼ŪĪŖ____________”£
£Ø2£©ŹµŃéŹŅæÉÓĆ“ĪĀČĖįÄĘČÜŅŗÓė°±·“Ó¦ÖʱøĮŖ°±£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ___________”£
£Ø3£©¢Ł2O2£Øg£©+N2£Øg£©=N2O4£Øl£© ”÷H1
¢ŚN2£Øg£©+2H2£Øg£©=N2H4£Øl£© ”÷H2
¢ŪO2£Øg£©+2H2£Øg£©=2H2O£Øg£© ”÷H3
¢Ü2 N2H4£Øl£© + N2O4£Øl£©= 3N2£Øg£©+ 4H2O£Øg£© ”÷H4=-1048.9kJ/mol
ÉĻŹö·“Ó¦ČČŠ§Ó¦Ö®¼äµÄ¹ŲĻµŹ½ĪŖ”÷H4=________________£¬ĮŖ°±ŗĶN2O4æÉ×÷ĪŖ»š¼żĶĘ½ų¼ĮµÄÖ÷ŅŖŌŅņĪŖ_________________________________________________”£
£Ø4£©ĮŖ°±ĪŖ¶žŌŖČõ¼ī£¬ŌŚĖ®ÖŠµÄµēĄė·½³ĢŹ½Óė°±ĻąĖĘ£¬ĮŖ°±µŚŅ»²½µēĄė·“Ó¦µÄĘ½ŗā³£ŹżÖµĪŖ___________________£ØŅŃÖŖ£ŗN2H4+H+![]() N2H5+µÄK=8.7”Į107£»KW=1.0”Į10-14£©”£ĮŖ°±ÓėĮņĖįŠĪ³ÉµÄĖįŹ½ŃĪµÄ»ÆѧŹ½ĪŖ ”£
N2H5+µÄK=8.7”Į107£»KW=1.0”Į10-14£©”£ĮŖ°±ÓėĮņĖįŠĪ³ÉµÄĖįŹ½ŃĪµÄ»ÆѧŹ½ĪŖ ”£
£Ø5£©ĮŖ°±ŹĒŅ»ÖÖ³£ÓƵĻ¹Ō¼Į”£Ļņ×°ÓŠÉŁĮæAgBrµÄŹŌ¹ÜÖŠ¼ÓČėĮŖ°±ČÜŅŗ£¬¹Ū²ģµ½µÄĻÖĻóŹĒ”£ĮŖ°±æÉÓĆÓŚ“¦ĄķøßŃ¹¹ųĀÆĖ®ÖŠµÄŃõ£¬·ĄÖ¹¹ųĀƱ»øÆŹ“”£ĄķĀŪÉĻ1kgµÄĮŖ°±æɳżČ„Ė®ÖŠČܽāµÄO2kg£»ÓėŹ¹ÓĆNa2SO3“¦ĄķĖ®ÖŠČܽāµÄO2Ļą±Č£¬ĮŖ°±µÄÓŵćŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±ūĻ©ėę£ØCH2=CHCN£©ŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬¹¤ŅµÉĻæÉÓĆ”°±ūĻ©°±Ńõ»Æ·Ø”±Éś²ś£¬Ö÷ŅŖø±²śĪļÓŠ±ūĻ©Č©£ØCH2=CHCHO£©ŗĶŅŅėęCH3CN µČ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŅŌ±ūĻ©”¢°±”¢ŃõĘųĪŖŌĮĻ£¬ŌŚ“߻ƼĮ“ęŌŚĻĀÉś³É±ūĻ©¾¦£ØC3H3N£©ŗĶø±²śĪļ±ūĻ©Č©£ØCH2=CHCHO£©µÄČČ»Æѧ·½³ĢŹ½ČēĻĀ£ŗ
¢Ł C3H6(g)+NH3(g)£«O2(g)=C3H3N(g)+3H2O(g£©”÷H=-515kJ/mol
¢Ś C3H6(g)+O2(g)=C3H4O(g)£«H2O(g) ”÷H=-353kJ/mol
ÓŠĄūÓŚĢįøß±ūĻ©ėęĘ½ŗā²śĀŹµÄ·“Ó¦Ģõ¼žŹĒ______£»Ģįøß±ūĻ©ė귓ӦєŌńŠŌµÄ¹Ų¼üŅņĖŲŹĒ_____.
£Ø2£©Ķ¼£Øa£©ĪŖ±ūĻ©ėę²śĀŹÓė·“Ó¦ĪĀ¶ČµÄ¹ŲĻµĒśĻߣ¬×īøß²śĀŹ¶ŌÓ¦ĪĀ¶ČĪŖ460”ę”£µĶÓŚ460”ꏱ£¬±ūĻ©ėęµÄ²śĀŹ________£ØĢī”°ŹĒ”±»ņÕß”°²»ŹĒ”±£©¶ŌÓ¦ĪĀ¶ČĻĀµÄĘ½ŗā²śĀŹ£¬ÅŠ¶ĻĄķÓÉŹĒ_____£»øßÓŚ460”ꏱ£¬±ūĻ©ėę²śĀŹ½µµĶµÄæÉÄÜŌŅņŹĒ________£ØĖ«Ń”£¬Ģī±źŗÅ£©”£
A£®“߻ƼĮ»īŠŌ½µµĶ B.Ę½ŗā³£Źż±ä“ó C£®ø±·“Ó¦Ōö¶ą D. ·“Ó¦»ī»ÆÄÜŌö“ó
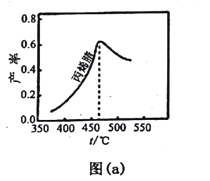
£Ø3£©±ūĻ©ėęŗĶ±ūĻ©Č©µÄ²śĀŹÓėn£Ø°±£©/n£Ø±ūĻ©£©µÄ¹ŲĻµČēĶ¼£Øb£©ĖłŹ¾”£ÓÉĶ¼æÉÖŖ£¬×ī¼Ńn£Ø°±£©/n£Ø±ūĻ©£©Ō¼ĪŖ_________ £¬ĄķÓÉŹĒ_______”£½ųĮĻ°±”¢æÕĘų”¢±ūĻ©µÄĄķĀŪĢå»żŌ¼ĪŖ____________”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ[»Æѧ--Ń”ŠŽ5£ŗÓŠ»ś»Æѧ»ł“”]
Ē軳±ūĻ©Ėįõ„ŌŚ¼īŠŌĢõ¼žĻĀÄÜæģĖŁ¾ŪŗĻĪŖ £¬“Ó¶ų¾ßÓŠ½ŗš¤ŠŌ£¬Ä³ÖÖĒ軳±ūĻ©Ėįõ„£ØG£©µÄŗĻ³ÉĀ·ĻßČēĻĀ£ŗ
£¬“Ó¶ų¾ßÓŠ½ŗš¤ŠŌ£¬Ä³ÖÖĒ軳±ūĻ©Ėįõ„£ØG£©µÄŗĻ³ÉĀ·ĻßČēĻĀ£ŗ
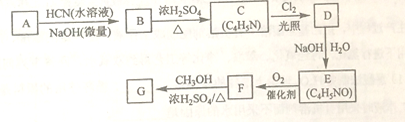
ŅŃÖŖ£ŗ
¢ŁAµÄĻą¶Ō·Ö×ÓĮæĪŖ58£¬ŃõŌŖĖŲÖŹĮæ·ÖŹżĪŖ0.276£¬ŗĖ“Ź²ÕńĒāĘ×ĻŌŹ¾ĪŖµ„·å
¢Ś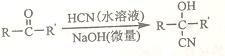
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©AµÄ»ÆѧĆū³ĘĪŖ_______”£
£Ø2£©BµÄ½į¹¹¼ņŹ½ĪŖ______£¬ĘäŗĖ“Ź²ÕńĒāĘ×ĻŌŹ¾ĪŖ______×é·å£¬·åĆ껿±ČĪŖ______”£
£Ø3£©ÓÉCÉś³ÉDµÄ·“Ó¦ĄąŠĶĪŖ________”£
£Ø4£©ÓÉDÉś³ÉEµÄ»Æѧ·½³ĢŹ½ĪŖ___________”£
£Ø5£©GÖŠµÄ¹ŁÄÜĶÅÓŠ___”¢ ____ ”¢_____”££ØĢī¹ŁÄÜĶÅĆū³Ę£©
£Ø6£©GµÄĶ¬·ÖŅģ¹¹ĢåÖŠ£¬ÓėG¾ßÓŠĻąĶ¬¹ŁÄÜĶÅĒŅÄÜ·¢ÉśŅų¾µ·“Ó¦µÄ¹²ÓŠ_____ÖÖ”££Ø²»ŗ¬Į¢ĢåŅģ¹¹£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ż³ĢÖŠ»Æѧ¼ü±»ĘĘ»µ£¬µ«²»ŹōÓŚ»Æѧ±ä»ÆµÄŹĒ
A.¾Ę¾«ČÜÓŚĖ®B.CaOČܽāÓŚĖ®
C.KOHŹÜČČČŪ»ÆD.°×Į×ŌŚŅ»¶ØĢõ¼žĻĀ×Ŗ»ÆĪŖŗģĮ×
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com