
分析 (1)4.9g硫酸的物质的量是0.05mol,每个硫酸分子中含有2个H原子、4个O原子、1个S原子,根据N=nNA计算这几种原子个数;每个水分子中含有1个O原子,则硫酸和水中O原子个数相等时硫酸和水的物质的量之比为1:4,根据m=nM计算水的质量;根据C=$\frac{n}{V}$计算硫酸物质的量浓度;
(2)标况下,44.8L二氧化碳的物质的量=$\frac{44.8L}{22.4L/mol}$;其质量m=nM计算二氧化碳质量;每个分子中含有3个原子、电子数是22、质子数是22;
(3)同温同压下,气体摩尔体积相等,相同体积的CO和二氧化碳的物质的量相等,根据N=nNA计算其分子数之比、根据m=nM、ρ=$\frac{M}{{V}_{m}}$结合分子构成计算.
解答 解:(1)4.9g硫酸的物质的量是0.05mol,每个硫酸分子中含有2个H原子、4个O原子、1个S原子,根据N=nNA知,H、O、S原子物质的量为0.1mol、0.2mol、0.05mol,则O、S原子个数分别是0.2NA、0.05NA;每个水分子中含有1个O原子,则硫酸和水中O原子个数相等时硫酸和水的物质的量之比为1:4,水的质量m=nM=0.05mol×4×18g/mol=3.6g;硫酸的物质的量浓度C=$\frac{n}{V}$=$\frac{0.05mol}{0.5L}$0.1 mol/L,
故答案为:0.1;0.2NA;0.05NA;3.6g;0.1 mol/L;
(2)标况下,44.8L二氧化碳的物质的量=$\frac{44.8L}{22.4L/mol}$;m(CO2)=nM=2mol×44g/mol=88g;每个分子中含有3个原子、电子数是22、质子数是22,则原子总数为6NA、电子总数为44NA、质子数是44NA,故答案为:2mol;88g;6NA;44NA;44NA;
(3)同温同压下,气体摩尔体积相等,相同体积的CO和二氧化碳的物质的量相等,根据N=nNA知,相同物质的量时其分子数相等,根据m=nM知,其质量之比等于摩尔质量之比=28g/mol:44g/mol=7:11,根据ρ=$\frac{M}{{V}_{m}}$知,相同条件下摩尔质量之比等于其摩尔质量之比=28g/mol:44g/mol=7:11,
故答案为:1:1;1:1;2:3;7:11;7:11.
点评 本题考查物质的量的有关计算,为高频考点,明确物质的量公式中各个物理量之间关系是解本题关键,注意气体摩尔体积适用范围及适用条件,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
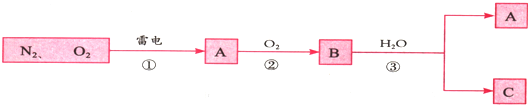
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 | |
| B. | 标准状况下,22.4 L水所含的水分子数为NA | |
| C. | 在常温常压下,11.2 L氮气所含的原子数目为NA | |
| D. | 34g氨气所含质子数目为20 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| B. | 使用催化剂能加快化学反应速率,提高产率 | |
| C. | 用氨的催化氧化法生产硝酸使用过量空气以提高氨气的利用率 | |
| D. | 实验室用排饱和食盐水法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米材料TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4在加热条件下水解生成TiO2•xH2O,经过过滤、水洗除去其中的Cl-,再经烘干、焙烧除去水分,最后得到粉体TiO2.
纳米材料TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.制备纳米TiO2的方法之一是TiCl4在加热条件下水解生成TiO2•xH2O,经过过滤、水洗除去其中的Cl-,再经烘干、焙烧除去水分,最后得到粉体TiO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 在容量瓶中进行定容时俯视刻度线 | |
| C. | 摇匀后,发现页面低于刻度线,又加水至刻度线 | |
| D. | 用蒸馏水洗净容量瓶后,容量瓶中残留有少量的蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 | |
| C. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O | |
| D. | 电池充电过程中,阴极附近溶液的pH降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com