


科目:高中化学 来源:不详 题型:单选题
| A.H2O2在①中是氧化剂,在②中是还原剂 |
| B.在①中每生成1 mol O2,转移的电子数为1.204×1024 |
| C.Mn2+在①中是还原产物,在②中是氧化产物 |
| D.在二氧化锰催化作用下,1 mol H2O2分解生成22.4 L O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 +3
+3 +aH+=2Cr3++3Y+4H2O下列说法不正确的是
+aH+=2Cr3++3Y+4H2O下列说法不正确的是A.Y是 |
| B.a=8 |
C. 被氧化成 被氧化成 |
D.生成1 mol 时转移的电子数是3×6.02×1023 时转移的电子数是3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH (CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。
(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。
2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl作氧化剂 |
| B.6mol NaOH参加反应转移6mol e- |
| C.被还原硒与被氧化硒的质量比为1:2 |
| D.被还原硒与被氧化硒的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
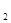 O,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
O,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是| A.1:4 | B.1:5 | C.2:3 | D.2:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com