
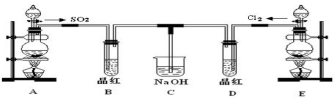
分析 装置A是制备二氧化硫气体通过装置B中品红溶液褪色,通入氢氧化钠溶液中吸收,装置E是制备氯气通入品红溶液褪色,剩余氯气通入氢氧化钠溶液吸收,
(1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
(2)SO2的漂白具有可逆性,次氯酸的漂白不可逆.
解答 解:(1)塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,造成分液漏斗内的压强小于大气压强,液体无法流出,
故答案为:分液漏斗的玻璃塞没有取下来;
(2)SO2具有漂白性,二氧化硫通入品红溶液中,品红褪色;SO2的漂白具有可逆性,褪色后的溶液加热时又恢复原来的红色.氯气和水反应生成的次氯酸具有漂白性,因而氯气通入品红溶液中也能使品红褪色,次氯酸的漂白不可逆,加热时,不能恢复红色,
故答案为:品红褪色;品红褪色;褪色的品红又恢复成红色;无明显现象;
点评 本题考查氯气和二氧化硫的漂白性质,题目难度不大,注意氯气和二氧化硫性质的不同.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 /mol-3•L3 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4(g)的反应为放热反应 | |
| B. | 在25℃时,反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为2×10-5 mol3•L-3 | |
| C. | 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时v正>v逆 | |
| D. | 在80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含硫酸的废液倒入水槽,用水冲入下水道 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 | |
| D. | 蒸馏操作时,加热到较高温度时,发现未加沸石,应立即打开瓶塞加入沸石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14g由N2和CO组成的混合气体中含有的电子总数为7 NA | |
| B. | 常温下,1 L pH=1的硫酸溶液中含有的H+数目为0.2 NA | |
| C. | 1 L 0.1 mol/L Na2CO3溶液中含有的CO32-数目为0.1 NA | |
| D. | 一定条件下,6.4 g SO2和足量的O2充分反应后,生成SO3的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给道路洒水,抑制扬尘 | B. | 提倡市民开私家车出行 | ||
| C. | 对裸露土地开展植树绿化 | D. | 对建筑工地、烧烤等加强管理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4所含分子数约为NA个 | |
| B. | 标准状况下,22.4L乙醇中含有的氧原子数目为NA | |
| C. | lmolNaHCO3晶体中含有阳离子数目为2NA | |
| D. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 230 | a |
| A. | 369 | B. | 384 | C. | 469 | D. | 499 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com