
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 取一定量的废水样品,经测定其中有n(Cu2+)=0.01mol,n(Fe2+)+n(Fe3+)=0.01mol,则该水样中0mol≤n(Cl-)≤0.05mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4mL恰好完全反应,然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.16g,则废水中c(Fe3+)=0.01 mol•L-1 |
分析 A.若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],NO3-浓度较大时,阴离子电荷总数多;
B.加适量盐酸,滴加KSCN溶液,溶液变红,可能亚铁离子被NO3-氧化;
C.由电荷守恒可知,若只有铁离子、铜离子、氯离子,则n(Cl-)=0.01×2+0.01×3=0.05mol;
D.0.16g为氧化铁,n(Fe)=$\frac{0.16g}{160g/mol}$×2=0.02mol,由电子守恒可计算亚铁离子的物质的量,结合c=$\frac{n}{V}$计算.
解答 解:A.若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],NO3-浓度较大时,阴离子电荷总数多,则由电荷守恒可知,溶液中可能存在Fe3+,故A错误;
B.加适量盐酸,滴加KSCN溶液,溶液变红,可能亚铁离子被NO3-氧化,不能确定是否含Fe3+,故B错误;
C.由电荷守恒可知,若只有铁离子、铜离子、氯离子,则n(Cl-)=0.01×2+0.01×3=0.05mol,溶液中可能不含氯离子,则该一定量的废水中0 mol≤n(Cl-)≤0.05mol,故C正确;
D.0.16g为氧化铁,n(Fe)=$\frac{0.16g}{160g/mol}$×2=0.01mol×2=0.02mol,由电子守恒可知,n(Fe2+)=$\frac{0.0224}{22.4}$×2×(1-0)mol=0.002mol,n(Fe2+)+n(Fe3+)=0.01mol,c(Fe3+)=$\frac{n}{V}$=$\frac{0.008mol}{0.01L}$=0.8mol/L,故D错误;
故选C.
点评 本题考查氧化还原反应计算及离子推断,为高考常见题型和高频考点,侧重于学生的分析能力和应用能力的考查,注意把握电子、电荷守恒,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1mol•L-1的Na2CO3溶液:K+、Ba+、NO32-、Cl- | |
| C. | 0.1mol•L-1的FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
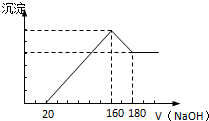 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为2mol/L的NaOH溶液,生成的沉淀与加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为2mol/L的NaOH溶液,生成的沉淀与加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
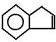 ,易发生加成、加聚等反应.茚有一种同分异构体A,A分子中的碳原子不完全在同一平面上,且A分子中含有一个苯环,A有如下转化关系:
,易发生加成、加聚等反应.茚有一种同分异构体A,A分子中的碳原子不完全在同一平面上,且A分子中含有一个苯环,A有如下转化关系: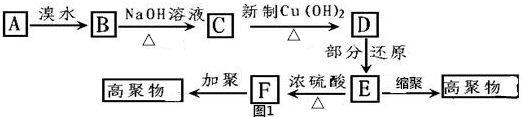
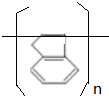 .
.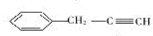 ,B是
,B是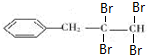 (均填结构简式).
(均填结构简式).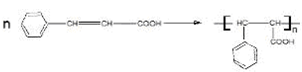 .
.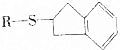 的反应类型是加成反应.
的反应类型是加成反应.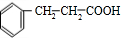 、
、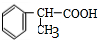 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K:1s22s22p63s23p64s1 | B. | Fˉ:1s22s22p6 | ||
| C. | Fe:1s22s22p63s23p63d54s3 | D. | Kr:1s22s22p63s23p63d104s24p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有可逆反应A(g)+B(g)?xC(g)+D(g),某温度时,在固定容积为2L的密闭容器内充入一定量的A、B,并保持温度不变.A、B、C、D物质的量随时间的变化如图所示:
有可逆反应A(g)+B(g)?xC(g)+D(g),某温度时,在固定容积为2L的密闭容器内充入一定量的A、B,并保持温度不变.A、B、C、D物质的量随时间的变化如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com