
| A. | 热的纯水 | B. | 热的烧碱 | C. | 冷的浓硫酸 | D. | 冷的硫酸铜溶液 |
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
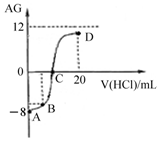 若用AG表示溶液的酸度,其表达式为:AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$].室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )
若用AG表示溶液的酸度,其表达式为:AG=lg[$\frac{{c({H^+})}}{{c(O{H^-})}}$].室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )| A. | 该滴定过程可选择酚酞作为指示剂 | |
| B. | 若B点加入的盐酸溶液体积为5 mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-) | |
| C. | 滴定过程中从A点到D点溶液中水的电离程度:A<B<C<D | |
| D. | C点时加入盐酸溶液的体积等于10 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02mol | B. | 0.03mol | C. | 0.05mol | D. | 0.17mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
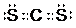 ,该分子为非极性(选填“极性”、“非极性”)分子.
,该分子为非极性(选填“极性”、“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 | |
| B. | 电池的正极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 电解后c(Na2CO3)不变,且溶液中有晶体析出 | |
| D. | 电池中c(KOH)不变;电解池中溶液pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
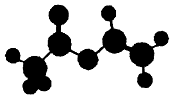 法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物与Br2的四氯化碳溶液不反应 | |
| C. | 该化合物既能发生水解反应,又能发生氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 待测物理量 | 测定方法 |
| ①乙酸溶液的物质的量浓度 | 量取25.00mL乙酸溶液于锥形瓶中,滴加指示剂,将0.1000mol/LNaOH标准溶液装入碱式滴定管,滴定至终点,记录数据.重复滴定2次. |
| ②H+的物质的量浓度 | 取适最乙酸溶液于烧杯中,用pH计或精密pH试纸测定溶液pH. |
| 编号 | 酸的种类 | 酸的浓度(mol/L) | 酸的体积/mL | 镁条质量/g |
| l | 乙酸 | 0.5 | 17.0 | 2.0 |
| 2 | 盐酸 | 0.5 | 17.0 | c |
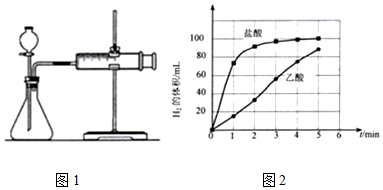
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com